Perbedaan antara ikatan punggung dan ikatan koordinat
Itu perbedaan utama antara ikatan punggung dan koordinat ikatan adalah itu back bonding refers to a chemical bond that forms between an atomic orbital of one atom and an antibonding orbital of a ligand whereas coordinate bonding refers to the sharing of a pair of electrons between an electronegative species and an electro-deficient species.
Obligasi koordinat umumnya terjadi di kompleks koordinasi di mana atom logam tengah dikelilingi oleh satu set ligan, yang terikat pada atom logam melalui ikatan koordinat. Di sini, ligan berbagi pasangan elektron tunggal mereka dengan atom logam. Tetapi, dalam ikatan punggung, ikatan kimia terbentuk antara orbital atom satu atom dan orbital antibondasi dari atom lain ketika mereka memiliki simetri yang setara. Dalam kimia organetalik, jenis ikatan kimia ini adalah umum.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa ikatan kembali
3. Apa ikatan koordinat
4. Perbandingan berdampingan - ikatan punggung vs ikatan koordinat dalam bentuk tabel
5. Ringkasan
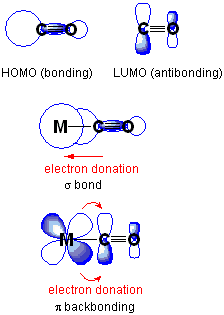
Apa ikatan kembali?
Ikatan kembali atau ikatan pi-back adalah situasi di mana elektron orbital atom dari satu atom pindah ke orbital antibonding atom lain, membentuk ikatan kimia. Di sini, dua bentuk orbital harus memiliki simetri yang tepat. Biasanya, atom dengan orbital atom adalah logam transisi sedangkan atom dengan orbital antibonding adalah bagian dari ligan pi-akseptor. Dalam kimia organetalik, jenis ikatan kimia ini adalah umum, dan memiliki logam transisi yang dikomplekskan dengan ligan multiatomik, E.G., karbon monoksida, etilena, ion nitrosonium.

Gambar 01: Donasi Kembali
Selain itu, ikatan punggung adalah proses sinergis. Ini melibatkan donasi elektron dari orbital yang diisi dengan elektron atau mengandung pasangan elektron yang sendirian ke dalam orbital kosong logam transisi, bersama dengan pelepasan elektron dari orbital logam ke dalam orbital antibondasi ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan dari ligan.
Apa ikatan koordinat?
Koordinat ikatan mengacu pada ikatan kovalen di mana elektron ikatan bersama disediakan oleh salah satu dari dua atom dalam ikatan. Itu berarti; Satu atom menyumbangkan salah satu pasangan elektron tunggal ke atom lain, dan pasangan elektron tunggal dibagi antara dua atom sesudahnya. Karena ini adalah donasi, kami dapat menyebutkannya sebagai ikatan datif atau ikatan dipolar juga.
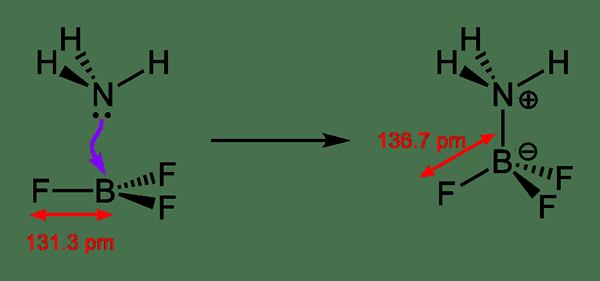
Gambar 02: Proses pembentukan ikatan dative
Saat menggambar struktur kimia, kita dapat menunjukkan ikatan koordinat menggunakan panah; Panah menunjukkan atom mana yang menerima elektron dan ekor panah dimulai dari atom yang menyumbangkan pasangan elektron. Namun, itu juga jenis ikatan kovalen; Oleh karena itu, kami mengganti panah ini dengan garis biasa untuk menunjukkan bahwa itu adalah ikatan di mana pasangan elektron dibagikan. Ikatan ini umumnya ditemukan di kompleks koordinasi di mana ion logam menerima pasangan elektron sendirian dari ligan.
Apa perbedaan antara ikatan punggung dan ikatan koordinat?
Ikatan punggung dan ikatan koordinat adalah dua ikatan kovalen yang berbeda. Perbedaan utama antara ikatan punggung dan ikatan koordinat adalah bahwa ikatan punggung mengacu pada ikatan kimia yang terbentuk antara orbital atom satu atom dan orbital antibondasi ligan sedangkan ikatan koordinat mengacu pada berbagi sepasang elektron antara spesies elektronegatif dan spesies yang kekurangan elektro.
Di bawah brief infografis perbedaan antara ikatan punggung dan ikatan koordinat.
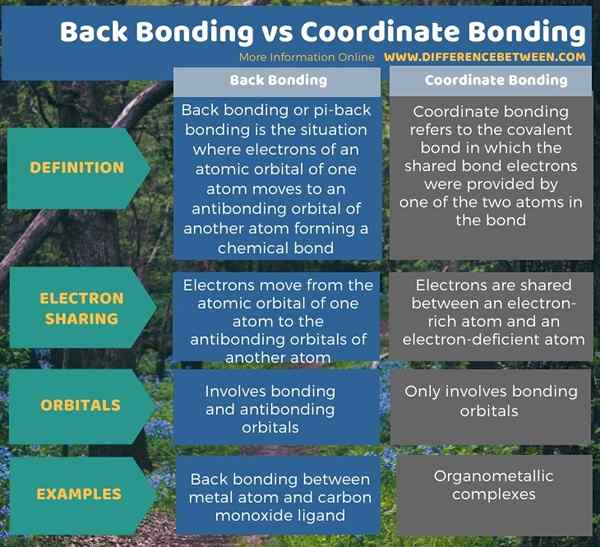
Ringkasan -ikatan kembali vs ikatan koordinat
Ikatan punggung dan ikatan koordinat adalah dua bentuk ikatan kovalen yang berbeda. Perbedaan utama antara ikatan punggung dan ikatan koordinat adalah bahwa ikatan punggung mengacu pada ikatan kimia yang terbentuk antara orbital atom satu atom dan orbital antibondasi ligan sedangkan ikatan koordinat mengacu pada berbagi sepasang elektron antara spesies elektronegatif dan spesies yang kekurangan elektro.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Obligasi Datif (Obligasi Koordinat)."Thoughtco, OCT. 14, 2019, tersedia di sini.
Gambar milik:
1. "Back Bonding" oleh OMCV - karya sendiri (domain publik) melalui Commons Wikimedia
2. "NH3-BF3-ADDUCT-BOND-LINGENING-2D" oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia


