Perbedaan antara penyesuaian dan netralisasi
Itu perbedaan utama antara penyesuaian dan netralisasi adalah itu Kesetaraan mengacu pada penyeimbangan atom -atom persamaan reaksi kimia, sedangkan netralisasi adalah penyeimbangan keasaman atau basa -basi untuk mendapatkan larutan netral.
Meskipun persamaan istilah dan netralisasi terdengar serupa, mereka berbeda satu sama lain dalam makna dan aplikasi. Namun, kedua istilah ini merujuk pada proses penyeimbangan komponen kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa penyesuaian
3. Apa itu netralisasi
4. Perbandingan Berdampingan -Kesetaraan vs Netralisasi dalam Bentuk Tabel
5. Ringkasan
Apa penyesuaian?
Penyamaan adalah teknik menyeimbangkan atom dari persamaan reaksi kimia. Di sini, kita harus menyamakan jumlah atom di sisi reaktan dengan jumlah atom di sisi produk. Ini berarti atomisitas sebelum dan sesudah reaksi kimia harus sama. Untuk tujuan ini, kita dapat menggunakan koefisien stoikiometrik di depan reaktan dan produk (koefisien stoikiometrik adalah angka yang muncul di hadapan simbol spesies kimia dalam persamaan untuk reaksi kimia. Nilai -nilai ini adalah nilai unitless).
Langkah -langkah berikut membantu kita menyeimbangkan persamaan kimia untuk reaksi kimia sederhana.
- Tuliskan persamaan yang tidak seimbang. (E.G. C3H8 + HAI2 ⟶ co2 + H2HAI)
- Tentukan jumlah masing -masing atom yang ada di sisi reaktan dan sisi produk. (Di sisi reaktan ada 8 atom hidrogen, 3 atom karbon dan 2 atom oksigen. Di sisi produk, ada 2 atom hidrogen, 3 atom oksigen dan satu atom karbon).
- Simpan atom hidrogen dan oksigen untuk yang terakhir.
- Gunakan koefisien stoikiometri untuk menyeimbangkan elemen tunggal. (Gunakan koefisien stoikiometrik "3" di depan CO2) e.G. C3H8 + HAI2 ⟶ 3BERSAMA2 + H2HAI
- Seimbangkan jumlah atom hidrogen. (Ada 8 atom hidrogen di sisi reaktan tetapi hanya 2 di sisi produk, jadi, kita harus menggunakan koefisien stoikiometrik 4 di depan h2O) e.G. C3H8 + HAI2 ⟶ 3co2 + 4H2HAI
- Menyeimbangkan jumlah atom oksigen. E.G. C3H8 + 5HAI2 ⟶ 3co2 + 4H2HAI
Apa itu netralisasi?
Reaksi netralisasi adalah reaksi kimia antara asam dan basa, yang menghasilkan larutan netral. Solusi netral akan selalu memiliki pH 7. Reaksi ini melibatkan kombinasi ion H+dan ohon untuk membentuk molekul air.
Jika pH akhir dari campuran reaksi asam dan basa adalah 7, itu berarti jumlah H+dan ion yang sama telah bereaksi di sini (untuk membentuk molekul air, satu ion H+dan satu ion diperlukan). Asam dan basa yang bereaksi bisa kuat atau lemah. Reaksi bervariasi tergantung pada fakta ini.

Gambar 01: Titrasi netralisasi basa asam kuat yang kuat
Ada empat jenis reaksi netralisasi yang berbeda: reaksi basa asam kuat yang kuat, reaksi basa asam yang kuat, reaksi basa-asam lemah, dan reaksi basa asam yang lemah. Reaksi ini mengalami netralisasi pada derajat yang berbeda, tergantung pada kekuatan asam dan basa.
Apa perbedaan antara penyesuaian dan netralisasi?
Perbedaan utama antara pemerataan dan netralisasi adalah bahwa penyamaan mengacu pada penyeimbangan atom -atom persamaan reaksi kimia sedangkan netralisasi adalah penyeimbangan keasaman atau basa -basi untuk mendapatkan larutan netral. Selain itu, pemerataan melibatkan penggunaan jumlah atom dalam reaktan dan produk dan menggunakan keadaan oksidasi atom, sedangkan netralisasi melibatkan penentuan kekuatan asam dan basa yang terlibat dalam reaksi.
Di bawah infografis merangkum perbedaan antara penyesuaian dan netralisasi.
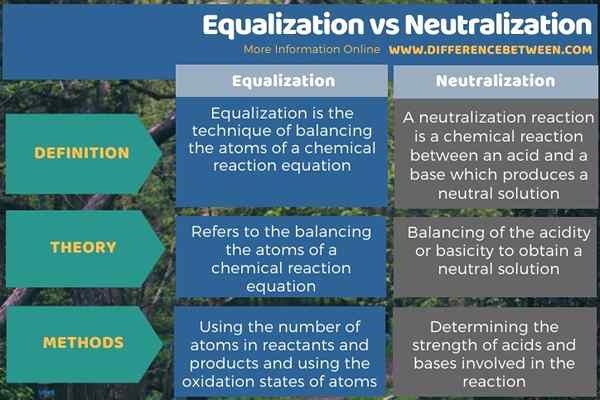
Ringkasan -Kesetaraan vs Netralisasi
Meskipun istilah pemerataan dan netralisasi terdengar serupa, mereka berbeda satu sama lain dalam definisi dan aplikasi. Perbedaan utama antara pemerataan dan netralisasi adalah bahwa penyamaan mengacu pada menyeimbangkan atom -atom persamaan reaksi kimia, sedangkan netralisasi menyeimbangkan keasaman atau kebesidangan untuk mendapatkan larutan netral.
Gambar milik:
2. "Titolazion" oleh Luigi Chiesa - Draw oleh Luigi Chiesa (domain publik) melalui Commons Wikimedia


