Apa perbedaan antara orbital molekul sigma dan pi
Itu Perbedaan utama antara orbital molekul sigma dan pi adalah bentuk orbital molekul sigma dari tumpang tindih orbital atom dalam arah head-to-head di sepanjang sumbu internuklear, sedangkan orbital molekul PI terbentuk dari tumpang tindih orbital atom dalam arah paralel yang paralel.
Orbital molekul sigma dan pi adalah dua jenis orbital molekul yang berkontribusi pada struktur aktual senyawa kimia. Orbital molekul bertanggung jawab atas pembentukan ikatan tunggal dan ganda atau tiga.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu orbital molekul
3. Apa itu orbital molekul sigma
4. Apa itu orbital molekul PI
5. Orbital molekul sigma vs pi dalam bentuk tabel
6. Ringkasan - Orbital Molekul Sigma vs Pi
Apa itu orbital molekuler?
Atom bergabung bersama untuk membentuk molekul. Ketika dua atom bergerak lebih dekat bersama untuk membentuk molekul, orbital atom tumpang tindih dan bergabung menjadi orbital molekuler. Jumlah orbital molekul yang baru terbentuk sama dengan jumlah orbital atom gabungan. Selain itu, orbital molekul mengelilingi dua inti atom, dan elektron dapat bergerak di sekitar kedua nuklei. Mirip dengan orbital atom, orbital molekul secara maksimal mengandung 2 elektron, yang memiliki putaran yang berlawanan.
Selain itu, ada dua jenis orbital molekul sebagai orbital molekul ikatan dan orbital molekul antibondasi. Orbital molekul ikatan mengandung elektron dalam keadaan tanah, sedangkan orbital molekul antibonding tidak mengandung elektron dalam keadaan tanah. Selain itu, elektron dapat menempati orbital antibonding jika molekulnya dalam keadaan tereksitasi.
Apa itu orbital molekul sigma?
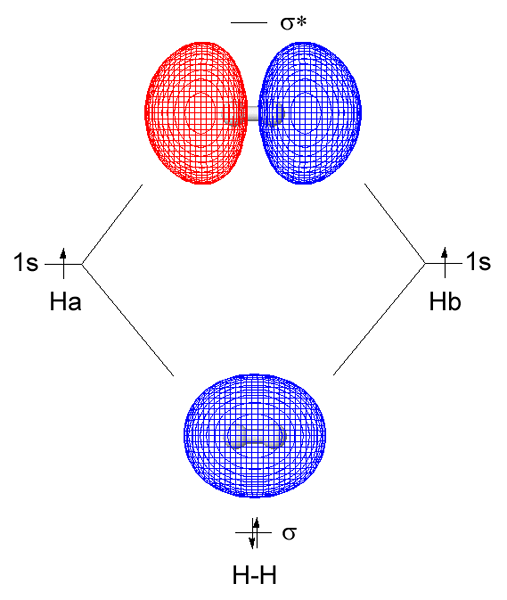
Orbital molekul sigma adalah jenis orbital hibrida yang terbentuk dari tumpang tindih dua orbital atom dari head-to-head di sepanjang sumbu internuclear. Biasanya, ikatan kovalen pertama antara dua atom selalu merupakan ikatan sigma. Tumpang tindih dua orbital atom dalam sumbu antar-nuklir membentuk ikatan kovalen sigma. Dalam orbital molekul sigma, kepadatan elektron di tengah orbital molekul tinggi jika dua atom dari mana orbital atom tumpang tindih identik.

Gambar 01: Molekul Hidrogen
Saat mempertimbangkan hidrogen sebagai contoh, bentuk orbital molekul sigma dari tumpang tindih dua orbital atom 1S yang berasal dari masing -masing atom hidrogen. Kita dapat menyingkat ikatan sigma ini sebagai σ. Di sini, kepadatan elektron bersama terjadi langsung antara atom ikatan di sepanjang sumbu ikatan. Ini membuat interaksi yang lebih stabil antara dua atom terikat bersama dengan elektron ikatan dibandingkan dengan stabilitas atom yang terpisah. Biasanya, ikatan sigma adalah ikatan pertama yang terbentuk antara dua atom.
Apa itu orbital molekul PI?
Orbital molekul PI adalah jenis orbital hibrida yang terbentuk dari tumpang tindih dua orbital atom dalam arah paralel. Di sini, kerapatan elektron ikatan terjadi di atas dan di bawah sumbu internuclear. Selanjutnya, kami tidak dapat mengamati elektron pada sumbu ikatan. Jenis interaksi antara dua atom ini membentuk pengaturan yang lebih stabil daripada stabilitas atom bebas yang terpisah. Biasanya, elektron cenderung menempati jenis orbital molekul ini ketika cukup banyak elektron yang ada dalam atom. Orbital molekul PI selalu terbentuk sebagai pembentukan orbital molekul kedua atau ketiga mengenai ikatan dua atom karena orbital molekul sigma adalah ikatan molekul pertama yang terbentuk antara dua atom.
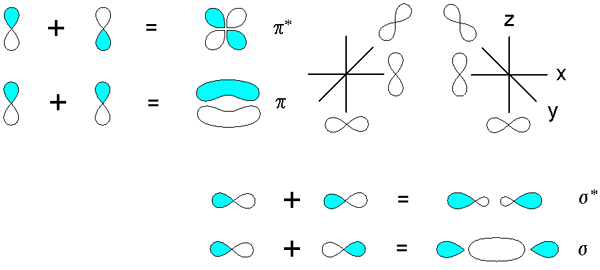
Gambar 02: Orbital Molekul PI
Selain itu, jumlah atom yang berkontribusi pada orbital atom P dari sistem PI selalu sama dengan jumlah orbital molekul PI yang ada dalam ikatan kimia. Biasanya, orbital molekul PI terendah memiliki nol node vertikal yang ada. Di sini, orbital molekul PI berturut -turut mendapatkan satu simpul vertikal tambahan setelah meningkatkan energi. Kita dapat menyingkat orbital molekul pi sebagai π.
Apa perbedaan antara orbital molekul sigma dan pi?
Orbital molekul sigma dan pi adalah dua jenis orbital molekul yang berkontribusi pada struktur aktual senyawa kimia. Perbedaan utama antara sigma dan orbital molekul PI adalah bahwa bentuk orbital molekul sigma dari orbital atom yang tumpang tindih dalam arah head-to-head di sepanjang sumbu internuklear, sedangkan orbital molekul PI yang tumpang tindih dari orbital atom yang tumpang tindih dalam arah paralel yang tumpang tindih dalam arah paralel yang tumpang tindih dalam suatu paralel.
Infografis berikut mencantumkan perbedaan antara orbital molekul Sigma dan PI dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -Orbital Molekul Sigma vs Pi
Orbital molekul adalah jenis orbital yang terbentuk dari tumpang tindih orbital atom. Perbedaan utama antara sigma dan orbital molekul PI adalah bahwa bentuk orbital molekul sigma dari orbital atom yang tumpang tindih dalam arah head-to-head di sepanjang sumbu internuklear, sedangkan orbital molekul PI yang tumpang tindih dari orbital atom yang tumpang tindih dalam arah paralel yang tumpang tindih dalam arah paralel yang tumpang tindih dalam suatu paralel.
Referensi:
1. “Apa itu orbital molekul sigma?" Byjus, 24 Des. 2020.
1. “15.3: PI orbital molekul benzena." Libreteks Kimia, Libretexts, 14 Juli 2020.
Gambar milik:
1. "Molekul Hidrogen" oleh Chiraljon (CC dengan 2.0) Via Flickr
2. “Mo Diagram Pi Orbitals” oleh V8Rik di EN.Wikipedia (CC BY-SA 3.0) Via Commons Wikimedia


