Perbedaan antara aktivitas dan fugacity
Itu perbedaan utama Antara aktivitas dan kekhilafan adalah itu Aktivitas mengacu pada konsentrasi efektif spesies kimia di bawah kondisi non-ideal, sedangkan fugacity mengacu pada tekanan parsial yang efektif dari spesies kimia di bawah kondisi non-ideal.
Aktivitas dan Fugacity adalah konsep kimia penting dalam termodinamika. Istilah-istilah ini didefinisikan untuk perilaku gas nyata yang tidak ideal.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu aktivitas
3. Apa itu fugacity
4. Perbandingan berdampingan - aktivitas vs fugacity dalam bentuk tabel
5. Ringkasan
Apa itu aktivitas?
Aktivitas adalah ukuran konsentrasi efektif spesies kimia di bawah perilaku non-ideal. Konsep aktivitas dirancang oleh ahli kimia Amerika Gilbert n. Lewis. Aktivitas adalah kuantitas tanpa dimensi. Nilai aktivitas untuk senyawa tertentu tergantung pada keadaan standar spesies itu. Misalnya, nilai untuk zat dalam fase padat atau cair diambil sebagai 1. Untuk gas, aktivitas ini mengacu pada tekanan parsial yang efektif, yang merupakan fugacity/tekanan gas yang kami pertimbangkan. Selain itu, aktivitas tergantung pada faktor -faktor berikut:
- Suhu
- Tekanan
- Komposisi campuran, dll.
Itu berarti; sekitarnya mempengaruhi aktivitas spesies kimia. Molekul gas dalam kondisi non-ideal cenderung berinteraksi satu sama lain, baik menarik atau saling berbelasan. Oleh karena itu, aktivitas molekul atau ion dipengaruhi oleh spesies kimia yang ada di sekitarnya.
Apa itu fugacity?
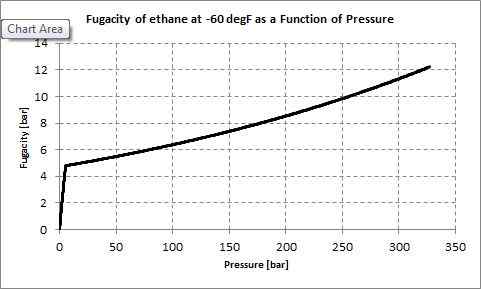
Fugacity adalah ukuran tekanan parsial efektif dari spesies kimia dalam kondisi non-ideal. Nilai fugacity untuk spesies kimia tertentu seperti gas asli sama dengan tekanan gas ideal yang memiliki suhu dan energi molar gibbs sama dengan gas asli. Kami dapat menentukan fugacity menggunakan metode eksperimental atau menggunakan beberapa model lain seperti gas van der Waals (yang lebih dekat ke gas asli daripada gas ideal).
Koefisien fugacity adalah hubungan antara tekanan gas asli dan fugacitynya. Kita dapat menunjukkannya menggunakan simbol ϕ. Hubungannya adalah,
ϕ = f/p
Di sini, f adalah fugacity, sedangkan p adalah tekanan dari gas asli. Untuk gas yang ideal, nilai tekanan dan fugacity sama. Oleh karena itu, koefisien fugacity untuk gas ideal adalah 1.

Gambar 01: Fugacity of Ethane
Selain itu, konsep fugacity ini terkait erat dengan aktivitas atau aktivitas termodinamika. Kita dapat memberikan hubungan ini, aktivitas = fugacity/tekanan.
Apa perbedaan antara aktivitas dan fugacity?
Perbedaan utama antara aktivitas dan fugacity adalah bahwa aktivitas mengacu pada konsentrasi efektif spesies kimia dalam kondisi non-ideal, sedangkan fugacity mengacu pada tekanan parsial efektif spesies kimia dalam kondisi non-ideal. Oleh karena itu, dalam konsep, aktivitas termodinamika adalah konsentrasi molekul nyata yang efektif, i.e. Gas Nyata, sedangkan Fugacity adalah tekanan parsial yang efektif dari gas nyata. Selain itu, kita dapat menentukan fugacity menggunakan metode eksperimental atau menggunakan beberapa model lain seperti gas van der Waals (yang lebih dekat dengan gas asli daripada gas ideal), dan nilai ini sama dengan aktivitas*tekanan gas asli.
Di bawah infografis merangkum perbedaan antara aktivitas dan fugacity.
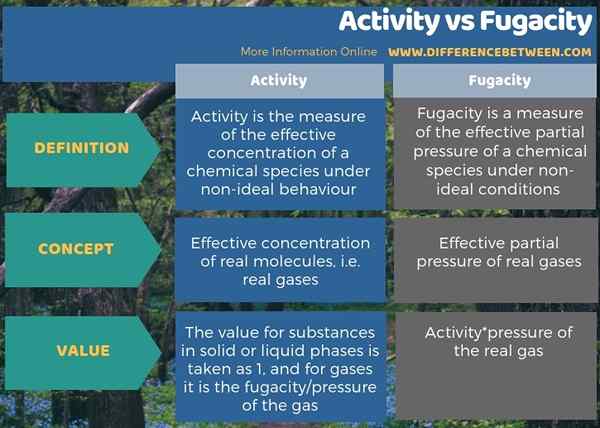
Ringkasan -Aktivitas vs Fugacity
Aktivitas dan Fugacity adalah konsep kimia penting dalam termodinamika. Singkatnya, perbedaan utama antara aktivitas dan fugacity adalah bahwa aktivitas mengacu pada konsentrasi efektif spesies kimia dalam kondisi non-ideal, sedangkan fugacity mengacu pada tekanan parsial efektif spesies kimia dalam kondisi non-ideal.
Referensi:
1. Jones, Andrew Zimmerman. “Hukum Termodinamika."Thoughtco, SEP. 7, 2019, tersedia di sini.
Gambar milik:
1. “Fugacity versus tekanan etana pada -60 degf” oleh Stieltjes -Grafik Excel Menggunakan Peng -Robinson EOS (CC BY -SA 3.0) Via Commons Wikimedia


