Perbedaan antara amphiprotic dan polyprotic
Itu perbedaan utama antara amfiprotik dan poliprotik adalah itu Amphiprotic mengacu pada kemampuan untuk menyumbangkan dan menerima proton, sedangkan polyprotic mengacu pada kemampuan untuk menyumbangkan atau menerima lebih dari satu proton.
Istilah amfiprotik dan polyprotic digunakan sebagai kata sifat untuk menggambarkan senyawa kimia. Istilah -istilah ini menggambarkan kemampuan atau ketidakmampuan untuk menyumbangkan/menerima proton. Dalam istilah ini, "-protik" berarti proton, yang merupakan H+ ion yang dapat dihilangkan dari senyawa kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Amphiprotic
3. Apa itu poliprotik
4. Perbandingan berdampingan - amphiprotic vs polyprotic dalam bentuk tabel
5. Ringkasan
Apa itu Amphiprotic?
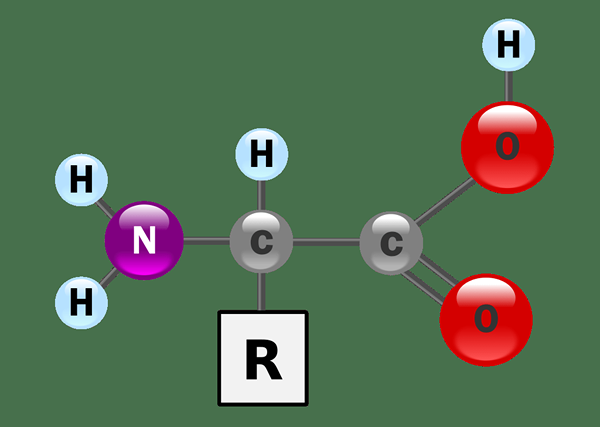
Amphiprotic mengacu pada kemampuan senyawa kimia untuk menyumbangkan atau menerima proton. Secara khusus, senyawa kimia amphiprotik dapat menyumbang dan menerima proton ke atau dari senyawa lain. Dalam konteks ini, kami merujuk pada h+ ion sebagai proton. Senyawa amphiprotik dapat berupa asam atau basa. Oleh karena itu, senyawa ini memiliki karakteristik asam dan basa.

Gambar 01: Asam amino adalah amfiprotik
Contoh untuk senyawa kimia amphiprotik termasuk asam amino, yang mengandung gugus amina dan gugus karboksilat, protein yang terdiri dari asam amino, dan air, yang mengandung proton dan pasangan elektron pada atom oksigen yang dapat bertindak sebagai akseptor proton proton.
Apa itu poliprotik?
Polyprotic mengacu pada kemampuan senyawa kimia untuk menyumbangkan lebih dari satu proton. Di sini, "poli" berarti banyak dan "-protik" berarti donasi proton. Ada dua jenis spesies kimia poliprotik sebagai asam poliprotik dan basa poliprotik.
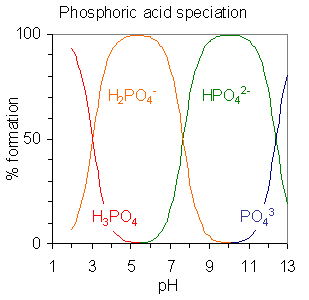
Gambar 02: Asam fosfat adalah asam poliprotik. Ini memiliki tiga proton yang dapat dilepas.
Asam poliprotik mampu melepaskan lebih dari satu proton per molekul. Basis polyprotic adalah spesies kimia yang mampu menerima lebih dari satu proton per molekul. Misalnya, asam sulfat, asam fosfat, asam karbonat, asam belerang, dll. adalah asam poliprotik. Ion fosfat, ion sulfat, ion karbonat, dll. adalah contoh untuk basis poliprotik.
Apa perbedaan antara amfiprotik dan poliprotik?
Istilah amfiprotik dan polyprotic merujuk pada penghapusan proton dari senyawa kimia. Perbedaan utama antara amphiprotic dan polyprotic adalah bahwa amfiprotik mengacu pada kemampuan untuk menyumbangkan dan menerima proton, sedangkan polyprotic mengacu pada kemampuan untuk menyumbangkan atau menerima lebih dari satu proton.
Selain itu, spesies kimia amphiprotik dapat menyumbangkan atau menerima satu atau lebih proton per molekul sedangkan spesies kimia poliprotik dapat menyumbang atau menerima lebih dari satu proton per molekul. Beberapa contoh untuk senyawa kimia amphiprotik termasuk asam amino, protein dan air, sedangkan contoh untuk spesies kimia poliprotik termasuk asam fosfat, asam sulfat, asam sulfat, dan ion fosfat.
Tabel berikut merangkum perbedaan antara spesies kimia amfiprotik dan poliprotik.

Ringkasan -Amphiprotic vs Polyprotic
Istilah amfiprotik dan polyprotic merujuk pada penghapusan proton dari senyawa kimia. Perbedaan utama antara amphiprotic dan polyprotic adalah bahwa amfiprotik mengacu pada kemampuan untuk menyumbangkan dan menerima proton sedangkan poliprotik mengacu pada kemampuan untuk menyumbangkan atau menerima lebih dari satu proton. Beberapa contoh untuk senyawa kimia amphiprotik termasuk asam amino, protein dan air sementara beberapa contoh untuk spesies kimia poliprotik termasuk asam fosfat, asam belerang, asam sulfat, dan ion fosfat.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Amphiprotik dalam Kimia."Thoughtco, Feb. 11, 2020, tersedia di sini.
2. “11.11: Spesies Amfiprotik.”Kimia Libretexts, Libretexts, 7 Feb. 2020, tersedia di sini.
3. “Asam dan basa poliprotik.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
Gambar milik:
1. "Amino Acid Ball" oleh gyassinemrabettalk✉ ini gambar vektor yang tidak ditentukan ini dibuat dengan inkscape. - Pekerjaan sendiri (domain publik) melalui commons wikimedia
2. "Phosphoric3" oleh Petergans (Talk) - Diagram distribusi spesies seperti yang dijelaskan dalam Bagian 2.4, domain publik) melalui commons wikimedia


