Perbedaan antara energi ikatan dan entalpi ikatan
Perbedaan Utama - Energi Bond vs Bond entalpi
Baik energi ikatan dan entalpi ikatan menggambarkan konsep kimia yang sama; Jumlah energi yang dibutuhkan untuk memecah mol molekul menjadi atom komponennya. Ini mengukur kekuatan ikatan kimia. Oleh karena itu juga disebut kekuatan ikatan. Energi ikatan dihitung sebagai nilai rata -rata energi disosiasi ikatan pada 298 K untuk spesies kimia dalam fase gas. Tidak ada perbedaan besar antara istilah energi ikatan dan entalpi ikatan, tetapi Energi ikatan dilambangkan dengan "e" sedangkan entalpi ikatan dilambangkan dengan "h".
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu energi ikatan
3. Apa itu entalpi ikatan
4. Perbandingan Berdampingan - Energi Bond Vs Onphalpy Bond dalam Bentuk Tabel
5. Ringkasan
Apa itu energi ikatan?
Energi ikatan atau entalpi ikatan adalah ukuran kekuatan ikatan. Energi ikatan adalah jumlah energi yang dibutuhkan untuk memecah mol molekul menjadi atom komponennya. Ini berarti energi ikatan adalah energi yang diperlukan untuk mematahkan ikatan kimia. Energi ikatan dilambangkan sebagai "E". Unit pengukuran adalah kJ/mol.
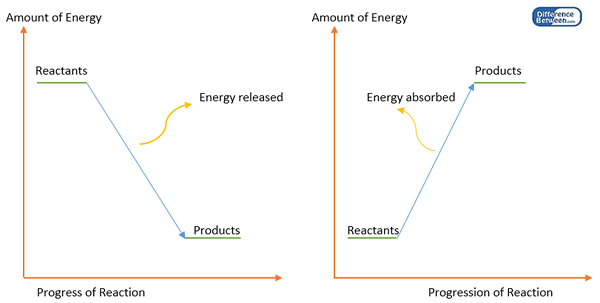
Ikatan kimia terbentuk antara atom untuk mendapatkan keadaan stabil ketika atom individu memiliki energi tinggi yang tidak stabil. Ini berarti pembentukan ikatan kimia mengurangi energi suatu sistem. Oleh karena itu, beberapa energi dilepaskan (biasanya sebagai panas) saat membentuk ikatan kimia. Oleh karena itu, pembentukan ikatan adalah reaksi eksotermik. Untuk mematahkan ikatan kimia ini, energi harus disediakan (jumlah energi yang sama dengan energi yang dilepaskan saat pembentukan ikatan). Jumlah energi ini dikenal sebagai energi ikatan atau entalpi ikatan.

Gambar 1: Diagram energi untuk pembentukan ikatan (kiri) dan disosiasi ikatan (kanan).
Energi ikatan sama dengan perbedaan antara entalpi produk (atom) dan reaktan (molekul awal). Setiap molekul harus memiliki nilai energi ikatan sendiri. Tapi ada pengecualian. Misalnya, energi ikatan ikatan C-H tergantung pada molekul di mana ikatan terjadi. Oleh karena itu, energi ikatan dihitung sebagai nilai rata -rata energi disosiasi ikatan.
Energi ikatan adalah energi disosiasi ikatan rata -rata untuk spesies yang sama dalam fase gas (pada suhu 298 K). Misalnya, energi ikatan molekul metana (CH4) adalah jumlah energi yang dibutuhkan untuk membentuk atom karbon dan 4 radikal hidrogen. Kemudian energi ikatan ikatan C-H dapat dihitung dengan mengambil jumlah energi disosiasi ikatan dari setiap ikatan C-H dan membagi nilai total dengan 4.
Mis: Energi ikatan ikatan O-H di H2O Molekul dapat dihitung sebagai berikut.
Jumlah energi yang dibutuhkan untuk memecahkan ikatan H-OH = 498.7 kJ/mol
Jumlah energi yang dibutuhkan untuk memecahkan ikatan O-H (dalam radikal OH yang tersisa) = 428 kJ/mol
Energi disosiasi ikatan rata -rata = (498.7 + 428) / 2
= 463.35 kJ/mol ≈ 464 kJ/mol
Oleh karena itu, energi ikatan O-H di H2O Molekul dianggap sebagai 464 kJ/mol.
Apa itu entalpi ikatan?
Entalpi ikatan atau energi ikatan adalah jumlah energi yang dibutuhkan untuk memisahkan molekul ke dalam komponen atomnya. Itu adalah ukuran kekuatan ikatan. Entalpi ikatan dilambangkan sebagai "h".
Apa perbedaan antara energi ikatan dan entalpi ikatan?
- Energi ikatan atau entalpi ikatan adalah jumlah energi yang dibutuhkan untuk memecah mol molekul menjadi atom komponennya.
- Energi ikatan dilambangkan sebagai "e" sementara entalpi ikatan dilambangkan sebagai "h".
Ringkasan -Energi Bond vs entalpi ikatan
Energi ikatan atau entalpi ikatan adalah jumlah energi yang dibutuhkan untuk memisahkan mol molekul menjadi komponen atomnya dalam fase gas. Itu dihitung dengan menggunakan nilai energi disosiasi ikatan ikatan kimia. Oleh karena itu energi ikatan adalah nilai rata -rata energi disosiasi ikatan. Itu selalu merupakan nilai positif karena disosiasi ikatan adalah endotermik (pembentukan ikatan adalah eksotermik). Tidak ada perbedaan yang cukup besar antara energi ikatan dan entalpi ikatan.
Referensi:
1. “Energi Bond.”Kimia Libretexts, Libretexts, 20 Januari. 2017, tersedia di sini.
2. Helmenstine, Anne Marie. “Apa itu energi ikatan?"Thoughtco, tersedia di sini.
3. “Energi ikatan.”Wikipedia, Wikimedia Foundation, 13 Mar. 2018, tersedia di sini.


