Perbedaan antara koefisien dan subskrip
Itu perbedaan utama Antara koefisien dan subskrip adalah itu Koefisien memberikan jumlah mol zat, sedangkan subskrip memberikan jumlah atom yang ada dalam suatu molekul.
Istilah koefisien dan subskrip sangat penting dalam kimia, khususnya dalam menulis persamaan kimia untuk reaksi. Kedua istilah ini merujuk pada angka, tetapi mereka memberikan detail yang berbeda tentang reaksi kimia tertentu.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu koefisien
3. Apa itu subskrip
4. Perbandingan berdampingan - koefisien vs subscript dalam bentuk tabel
5. Ringkasan
Apa itu koefisien?
Koefisien adalah angka yang memberikan jumlah mol zat yang mengambil bagian dalam reaksi kimia tertentu. Kami menulis nomor ini di depan zat saat menulis formula kimia. Selain itu, kita dapat menulis koefisien dalam ukuran yang sama dengan simbol kimia lainnya (bukan sebagai subskrip atau sebagai superskrip). Mari kita pertimbangkan reaksi kimia berikut sebagai contoh.
N2 + 3H2 ⟶ 2nh3
Dalam reaksi kimia di atas, "3" di depan h2 dan "2" di depan NH3 adalah koefisien. Meskipun tidak ada koefisien di depan n2, Anda harus tahu bahwa ada "1". Angka -angka ini mengungkapkan bahwa reaksi ini membutuhkan satu mol gas nitrogen dan tiga mol gas hidrogen untuk sepenuhnya bereaksi, memberikan dua mol amonia.
Apa itu subskrip?
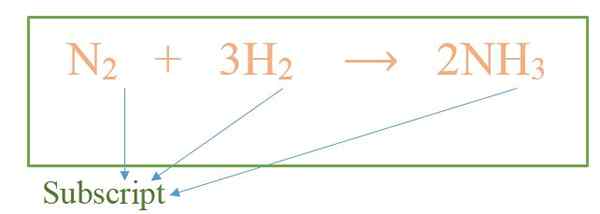
Subskrip adalah angka yang memberikan jumlah atom yang ada dalam molekul tertentu. Jumlahnya penting dalam menulis formula kimia zat dan persamaan kimia untuk reaksi. Lebih lanjut, subskrip ditulis dalam ukuran yang lebih kecil dari simbol kimia lainnya dalam rumus; Kami juga menulisnya di bagian bawah simbol atom tertentu. Mari kita pertimbangkan contoh yang sama seperti di atas.

Dalam contoh di atas, gas nitrogen memiliki dua atom nitrogen per molekul; Dengan demikian, subskrip adalah "2". Untuk gas hidrogen, subskripnya sama. Tetapi dalam molekul amonia, ada satu atom nitrogen; Jadi, subskripnya adalah "1", tetapi kami tidak menulisnya karena sebagai aturan umum. Oleh karena itu, jika hanya memiliki simbol dan tidak ada subskrip, maka pada dasarnya "1". Molekul amonia memiliki tiga atom hidrogen. Jadi, subskrip di sana adalah "3".
Apa perbedaan antara koefisien dan subskrip?
Baik koefisien dan subskrip mengacu pada angka, tetapi mereka memberikan detail yang berbeda tentang reaksi kimia tertentu. Perbedaan utama antara koefisien dan subskrip adalah bahwa koefisien memberikan jumlah mol zat, sedangkan subskrip memberikan jumlah atom yang ada dalam molekul. Misalnya, dalam persamaan kimia “n2 + 3H2 ⟶ 2nh3”, Koefisien di depan gas nitrogen adalah 1, dan koefisien di depan hidrogen adalah 3; Di depan amonia, koefisiennya adalah 2. Sebagai contoh yang sama, “n2 + 3H2 ⟶ 2nh3”, Subskrip nitrogen dalam gas nitrogen adalah 2, tetapi dalam molekul amonia, subskrip atom nitrogen adalah 1.
Di bawah infografis merangkum perbedaan antara koefisien dan subskrip.

Ringkasan -Koefisien vs Subskrip
Kedua istilah koefisien dan subskrip mengacu pada angka, tetapi mereka memberikan detail yang berbeda tentang reaksi kimia tertentu. Perbedaan utama antara koefisien dan subskrip adalah bahwa koefisien memberikan jumlah mol zat, sedangkan subskrip memberikan jumlah atom yang ada dalam molekul.


