Perbedaan antara delokalisasi dan resonansi
Itu perbedaan utama antara delokalisasi dan resonansi adalah itu Delokalisasi mengacu pada elektron yang didistribusikan di seluruh area molekul daripada melekat pada molekul tunggal sedangkan resonansi mengacu pada stabilisasi molekul karena delokalisasi elektron.
Delokalisasi dan resonansi adalah konsep kimia terkait; Efek resonansi dijelaskan dengan menggunakan delokalisasi elektron senyawa kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu delokalisasi
3. Apa itu resonansi
4. Perbandingan berdampingan - Delokalisasi vs Resonansi dalam bentuk tabel
5. Ringkasan
Apa itu delokalisasi?
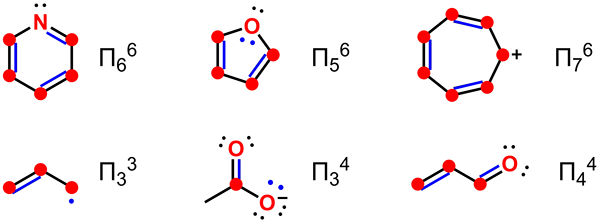
Delokalisasi adalah istilah yang mengacu pada distribusi elektron PI nonbonding melalui molekul. Oleh karena itu, kita dapat menggambarkan elektron yang didelokalisasi sebagai elektron nonbonding dalam senyawa kimia itu. Istilah delokalisasi mengacu pada elektron yang tidak terkait dengan atom tunggal atau ikatan kovalen. Namun demikian, istilah elektron yang didelokalisasi memiliki makna yang berbeda di bidang yang berbeda. Sebagai contoh, dalam kimia organik, elektron yang didelokalisasi berada dalam struktur resonansi sistem terkonjugasi dalam senyawa aromatik. Demikian pula, dalam fisika solid-state, elektron yang didelokalisasi adalah elektron bebas yang memfasilitasi konduksi listrik. Selain itu, fisika kuantum menggunakan istilah elektron yang didelokalisasi untuk merujuk pada elektron orbital molekuler yang telah meluas lebih dari beberapa atom.

Gambar 01: Delokalisasi elektron dalam molekul
Contoh paling sederhana yang dapat kita berikan untuk sistem aromatik yang memiliki elektron yang didelokalisasi adalah cincin benzena. Cincin benzena memiliki enam elektron pi dalam molekul benzena; Kami sering menunjukkan ini secara grafis menggunakan lingkaran. Lingkaran ini berarti bahwa elektron PI dikaitkan dengan semua atom dalam molekul. Delokalisasi ini membuat cincin benzena memiliki ikatan kimia dengan panjang ikatan yang sama.
Apa itu resonansi?
Resonansi adalah konsep dalam kimia yang menggambarkan interaksi antara pasangan elektron tunggal dan pasangan elektron ikatan suatu senyawa. Efek resonansi membantu menentukan struktur kimia aktual dari senyawa organik atau anorganik tersebut. Efek ini muncul dalam senyawa yang memiliki ikatan rangkap dan pasangan elektron tunggal. Selain itu, efek ini menyebabkan polaritas molekul.
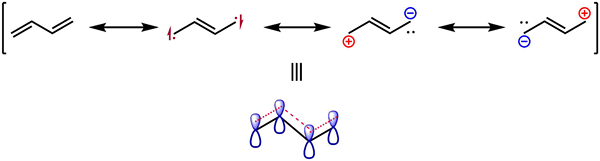
Gambar 02: Struktur Resonansi Butadiene
Efek resonansi menunjukkan stabilisasi senyawa kimia melalui elektron mendelokalisasi dalam ikatan PI. Secara umum, elektron dalam molekul dapat bergerak di sekitar inti atom karena elektron tidak memiliki posisi tetap di dalam atom. Oleh karena itu, pasangan elektron tunggal dapat pindah ke ikatan PI dan sebaliknya. Ini terjadi untuk mendapatkan keadaan yang stabil. Proses pergerakan elektron ini dikenal sebagai resonansi. Selain itu, kita dapat menggunakan struktur resonansi untuk mendapatkan struktur molekul yang paling stabil.
Molekul dapat memiliki beberapa struktur resonansi berdasarkan jumlah pasangan tunggal dan ikatan PI yang ada dalam molekul itu. Semua struktur resonansi molekul memiliki jumlah elektron yang sama dan susunan atom yang sama. Struktur aktual molekul itu adalah struktur hibrida di semua struktur resonansi. Ada dua jenis efek resonansi: efek resonansi positif dan efek resonansi negatif.
Efek resonansi positif menjelaskan resonansi yang dapat ditemukan dalam senyawa yang memiliki muatan positif. Efek resonansi positif membantu menstabilkan muatan positif dalam molekul itu. Efek resonansi negatif menjelaskan stabilisasi muatan negatif dalam molekul. Namun, struktur hibrida yang diperoleh dengan mempertimbangkan resonansi memiliki energi yang lebih rendah daripada semua struktur resonansi.
Apa perbedaan antara delokalisasi dan resonansi?
Delokalisasi dan resonansi adalah dua konsep kimia terkait. Perbedaan utama antara delokalisasi dan resonansi adalah bahwa delokalisasi mengacu pada elektron yang didistribusikan di seluruh area molekul daripada melekat pada molekul tunggal sedangkan resonansi mengacu pada stabilisasi molekul karena delokalisasi elektron.
Selain itu, delokalisasi terjadi pada molekul yang memiliki ikatan tunggal alternatif dan ikatan rangkap atau ikatan rangkap tiga sementara resonansi terjadi dalam sistem terkonjugasi, atau molekul yang memiliki muatan listrik bergerak yang dapat dipindahkan.
Di bawah infografis merangkum perbedaan antara delokalisasi dan resonansi.
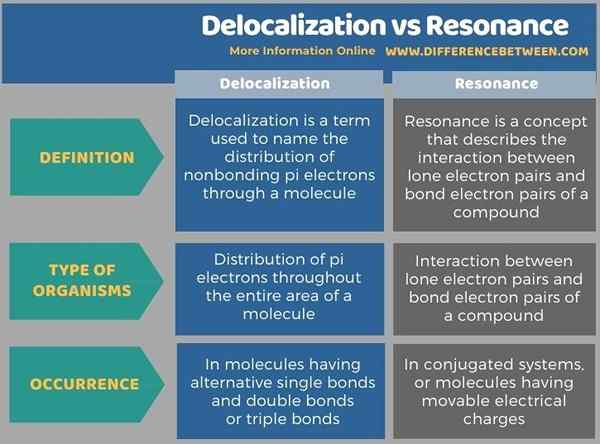
Ringkasan -Delokalisasi vs Resonansi
Delokalisasi dan resonansi adalah konsep kimia terkait; Efek resonansi dijelaskan dengan menggunakan delokalisasi elektron senyawa kimia. Perbedaan utama antara delokalisasi dan resonansi adalah bahwa delokalisasi mengacu pada elektron yang didistribusikan di seluruh area molekul daripada melekat pada molekul tunggal sedangkan resonansi mengacu pada stabilisasi molekul karena delokalisasi elektron.
Referensi:
1. “Delokalisasi elektron."Libretexts. Tersedia disini.
Gambar milik:
1. "Delocalization-diperbarui" oleh AlsoSaid1987-karya sendiri (CC BY-SA 4.0) Via Commons Wikimedia
2. “Butadiene-Resonance” oleh AlsoSaid1987-Karya Sendiri (CC BY-SA 4.0) Via Commons Wikimedia


