Perbedaan antara hukum tingkat diferensial dan hukum tarif terintegrasi
Perbedaan Utama - Hukum Tingkat Diferensial vs Hukum Tingkat Terpadu
Hukum tingkat diferensial dan hukum tarif terintegrasi adalah dua bentuk undang -undang tarif. Perbedaan utama antara hukum tingkat diferensial dan hukum tingkat terintegrasi adalah bahwa Hukum laju diferensial memberikan laju reaksi kimia sebagai fungsi dari perubahan konsentrasi satu atau lebih reaktan selama periode waktu tertentu sedangkan hukum laju terintegrasi memberikan laju reaksi kimia sebagai fungsi konsentrasi awal satu atau lebih reaktan setelah periode waktu tertentu.
Laju reaksi adalah ukuran perubahan konsentrasi reaktan atau produk selama perkembangan reaksi kimia. Undang -undang laju yang berbeda digunakan untuk menjelaskan kemajuan reaksi. Undang -undang tingkat ini dinyatakan sebagai hubungan matematika antara parameter yang berbeda.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Hukum Tingkat diferensial
3. Apa itu Hukum Tingkat Terpadu
4. Hubungan antara hukum tingkat diferensial dan hukum tingkat terintegrasi
5. Perbandingan Berdampingan - Hukum Tingkat Diferensial vs Hukum Tingkat Terpadu dalam bentuk tabel
6. Ringkasan
Apa itu Hukum Tingkat diferensial?
Hukum laju diferensial digunakan untuk menentukan laju reaksi kimia sebagai fungsi dari perubahan konsentrasi satu atau lebih reaktan selama periode waktu tertentu. Hukum laju diferensial menunjukkan apa yang terjadi pada tingkat molekuler reaksi kimia. Mekanisme keseluruhan reaksi kimia dapat ditentukan dengan menggunakan hukum laju diferensial (konversi reaktan menjadi produk).
Persamaan hukum tingkat diferensial
Hukum laju diferensial untuk reaksi kimia di bawah ini dapat diberikan sebagai ekspresi matematika.
A → B + C
Rate = - d [a] / dt = k [a]N
Di sini, [A] adalah konsentrasi reaktan "A" dan "K" adalah konstanta laju. "N" memberikan urutan reaksi. Persamaan hukum tingkat diferensial dapat diintegrasikan untuk mendapatkan hubungan yang jelas antara [a] dan waktu "t". Integrasi ini memberikan undang -undang tarif terintegrasi.

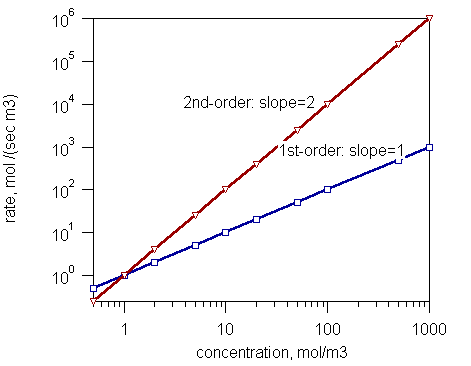
Gambar 1: Grafik yang menunjukkan urutan reaksi
Apa itu Hukum Tingkat Terpadu?
Undang -undang laju terintegrasi memberikan laju reaksi kimia sebagai fungsi dari konsentrasi awal satu atau lebih reaktan setelah periode waktu tertentu. Hukum laju terintegrasi dapat digunakan untuk menentukan konstanta laju reaksi kimia tertentu, dan urutan reaksi dapat diperoleh melalui data eksperimental.
Persamaan Hukum Tingkat Terpadu
Untuk reaksi kimia A → B + C, hukum laju terintegrasi dapat dinyatakan sebagai ekspresi matematika seperti yang diberikan di bawah ini.
ln [a] = -kt + ln [a]0
Di sini, [a]0 adalah konsentrasi awal reaktan A dan [a] adalah konsentrasi reaktan "A" setelah waktu "t" telah berlalu. Namun, undang -undang laju terintegrasi berbeda satu sama lain berdasarkan urutan reaksi "n". Persamaan di atas diberikan untuk reaksi kimia nol pesanan.
Untuk reaksi urutan pertama, Persamaan hukum tingkat adalah,
[A] = [a] e-KT
Untuk Reaksi urutan kedua, Persamaan hukum tingkat adalah,
1/[a] = 1/[a]0 + KT
Untuk menentukan laju konstanta reaksi, Persamaan di atas dapat digunakan sebagai berikut.
Untuk reaksi pesanan pertama,
k = ln [a] - ln [a]0 / T
Untuk reaksi pesanan kedua,
k = 1/[a] - 1/[a]0 / T
Apa hubungan antara hukum tingkat diferensial dan hukum tarif terintegrasi?
- Hukum laju diferensial suatu reaksi kimia dapat diintegrasikan untuk mendapatkan hukum laju terintegrasi dari reaksi kimia yang sama.
Apa perbedaan antara hukum tingkat diferensial dan hukum tarif terintegrasi?
Hukum tingkat diferensial vs hukum tarif terintegrasi | |
| Hukum laju diferensial digunakan untuk menentukan laju reaksi kimia sebagai fungsi dari perubahan konsentrasi satu atau lebih reaktan selama periode waktu tertentu. | Hukum laju terintegrasi memberikan laju reaksi kimia sebagai fungsi dari konsentrasi awal (atau konsentrasi pada saat tertentu) dari satu atau lebih reaktan setelah periode waktu tertentu. |
| Aplikasi | |
| Hukum laju diferensial dapat digunakan untuk menunjukkan apa yang terjadi pada tingkat molekuler reaksi kimia dan, mekanisme keseluruhan reaksi kimia dapat ditentukan dengan menggunakan undang -undang laju ini. | Hukum laju terintegrasi dapat digunakan untuk menentukan konstanta laju reaksi kimia tertentu. |
| Penggunaan | |
| Hukum tingkat diferensial sulit digunakan jika dibandingkan dengan hukum tarif terintegrasi. | Hukum terintegrasi memudahkan untuk menentukan hubungan yang jelas antara konsentrasi reaktan dan waktu berlalu. |
Ringkasan -Hukum Tingkat Diferensial vs Hukum Tingkat Terpadu
Hukum laju reaksi kimia memberikan hubungan antara laju reaksi dan konsentrasi reaktan. Perbedaan utama antara hukum laju diferensial dan undang -undang laju terintegrasi adalah bahwa undang -undang laju diferensial memberikan laju reaksi kimia sebagai fungsi dari perubahan konsentrasi satu atau lebih reaktan selama periode waktu tertentu sedangkan undang -undang laju terintegrasi memberikan tingkat tingkat reaksi kimia sebagai fungsi konsentrasi awal satu atau lebih reaktan setelah periode waktu tertentu.
Referensi:
1. “Tingkat hukum - diferensial.”Kimia Libretexts, Libretexts, 17 Juli 2015, tersedia di sini.
2. Libretexts. “12.4: Undang -undang Tingkat Terpadu.”Libretexts Chemistry, Libretexts, 11 September. 2017, tersedia di sini.]
Gambar milik:
1. "Rateloglogplot" oleh Fabiuccio ~ enwikibooks di Wikibooks Inggris - ditransfer dari EN.wikibooks ke commons.(Domain publik) via commons wikimedia


