Perbedaan antara potensial elektroda dan potensi sel
Itu perbedaan utama Antara potensial elektroda dan potensi sel adalah itu Potensi elektroda mengacu pada kemampuan elektroda dalam sel untuk dikurangi atau dioksidasi sedangkan potensial sel adalah perbedaan antara potensial elektroda elektroda yang ada dalam sel elektrokimia.
Potensi elektroda dan potensial sel adalah istilah yang menjelaskan gaya elektromotif sel elektrokimia. Potensi elektroda memberikan potensi volta dari elektroda tunggal sedangkan potensial sel mempertimbangkan potensial elektroda dari kedua elektroda.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa potensi elektroda
3. Apa itu potensial sel
4. Perbandingan berdampingan - potensi potensial elektroda vs sel dalam bentuk tabel
5. Ringkasan
Apa potensi elektroda?
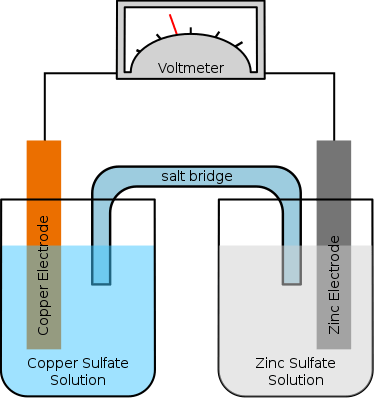
Potensi elektroda adalah kecenderungan elektroda dalam sel elektrokimia untuk dikurangi atau dioksidasi. Itu adalah gaya elektromotif sel. Ada tiga faktor yang mempengaruhi nilai potensial elektroda: sifat elektroda, konsentrasi ion dalam larutan dan suhu elektrolitik. Untuk sel elektrokimia apa pun, potensi total adalah jumlah potensial elektroda dari dua elektroda. Kita dapat menunjukkan potensi elektroda sebagai e. Namun, kami tidak dapat mengukur potensi elektroda secara terpisah. Itu harus diukur dalam reaksi dengan beberapa elektroda lainnya.

Gambar 01: Sel elektrokimia sederhana
Selain itu, potensial elektroda tergantung pada konsentrasi elektroda, suhu sel elektrokimia, dan juga tekanan (jika sel mengandung elektroda gas). Secara umum, potensial elektroda diukur sehubungan dengan elektroda standar.
Elektroda standar khas adalah elektroda hidrogen dan potensi elektroda diambil sebagai nol. Selain itu, kita harus menggunakan kondisi termodinamika standar dalam rangka saat mengukur potensi; Kalau tidak, kita tidak bisa mendapatkan nilai potensial yang tepat karena potensial elektroda tergantung pada suhu, tekanan, dll. Di sini, kondisi termodinamika standar termasuk mengukur terhadap elektroda hidrogen, larutan elektrolitik yang memiliki konsentrasi 1 mol/L, tekanan 1 atm, dan suhu 25 ° C.
Apa itu potensial sel?
Potensi sel mengacu pada potensi volta total sel elektrokimia yang memiliki dua elektroda. Di sini, sel-sel elektrokimia harus memiliki dua reaksi setengah terpisah yang terjadi sejajar satu sama lain dan kemudian, potensi sel adalah sebagai berikut:
Esel = Potensi oksidasi+ potensi reduksi
Oleh karena itu, potensial sel adalah jumlah dari potensial elektroda katoda dan potensial elektroda anoda. Sel volta nyata berbeda dari kondisi standar. Oleh karena itu, kita perlu menyesuaikan nilai eksperimental untuk mendapatkan nilai standar. Ini sebagai berikut:
Esel = E0sel - (Rt/nf) lnq
Dimana esel adalah potensi sel eksperimental, e0sel adalah potensi sel standar, r adalah konstanta universal, t adalah suhu, n adalah mol elektron yang dipertukarkan dalam reaksi setengah, f adalah konstanta faraday dan q adalah hasil bagi reaksi termodinamika termodinamika.
Apa perbedaan antara potensial elektroda dan potensi sel?
Perbedaan utama antara potensial elektroda dan potensial sel adalah bahwa potensial elektroda mengacu pada kemampuan elektroda dalam sel untuk dikurangi atau dioksidasi sedangkan potensial sel adalah perbedaan antara potensi elektroda elektroda yang ada dalam sel elektrokimia elektrokimia. Oleh karena itu, potensial elektroda memberikan potensi volta dari elektroda tunggal sedangkan potensial sel mempertimbangkan kedua elektroda.
Selain itu, perbedaan signifikan lainnya antara potensial elektroda dan potensial sel adalah tidak mungkin untuk mengukur potensial elektroda karena merupakan nilai relatif, tetapi potensial sel dapat dengan mudah diukur karena kita perlu menemukan perbedaan potensial elektroda, yang merupakan nilai relatif.
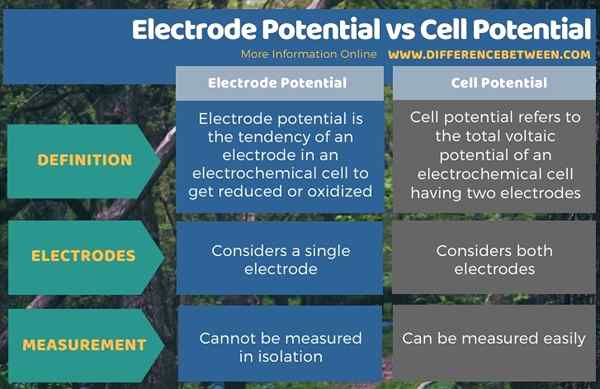
Ringkasan -potensi potensial elektroda vs pot sel
Potensi elektroda dan potensial sel dibahas di bawah elektrokimia, mengenai sel elektrokimia. Perbedaan utama antara potensial elektroda dan potensial sel adalah bahwa potensial elektroda mengacu pada kemampuan elektroda dalam sel untuk dikurangi atau dioksidasi sedangkan potensial sel adalah perbedaan antara potensi elektroda elektroda yang ada dalam sel elektrokimia elektrokimia.
Referensi:
1. “Potensi elektroda standar." Hyperphysics, Tersedia disini.
Gambar milik:
1. "Galvanic Cell" oleh Gringer - File: Galvanische Zelle.PNG, oleh Tinux (CC BY-SA 3.0) Via Commons Wikimedia


