Perbedaan antara ikatan elektrovalen dan kovalen
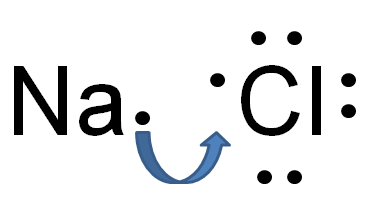
Perbedaan utama antara ikatan elektrovalen dan kovalen adalah itu ikatan elektrovalen terjadi dengan mentransfer elektron dari satu atom ke atom lainnya sedangkan Ikatan kovalen terjadi sebagai akibat dari berbagi elektron valensi antara atom. Ikatan ionik juga disebut ikatan elektrovalen. Elektron valensi, yang merupakan elektron yang terletak di cangkang terluar atom, terlibat dalam kedua jenis ikatan kimia.
Ikatan kimia adalah kunci untuk membentuk berbagai jenis senyawa kimia. Itu bertindak sebagai lem untuk menyatukan atom atau molekul. Tujuan utama ikatan kimia adalah untuk menghasilkan senyawa kimia yang stabil. Saat ikatan kimia terbentuk, energi dilepaskan, membentuk senyawa yang stabil. Ada tiga jenis utama ikatan kimia yang dikenal sebagai ikatan ionik, ikatan kovalen, dan ikatan logam atau non-kovalen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ikatan elektrovalen
3. Apa itu ikatan kovalen
4. Perbandingan berdampingan - ikatan elektrovalen vs kovalen
5. Ringkasan
Apa itu ikatan elektrovalen?
Ikatan elektrovalen atau ionik adalah jenis ikatan kimia yang dibentuk sebagai hasil dari transfer elektron dari satu atom ke atom lainnya. Transfer ini menyebabkan satu atom mendapatkan biaya positif dan atom lainnya untuk dibebankan secara negatif. Atom donor elektron menjadi bermuatan positif; Oleh karena itu, ini disebut kation sedangkan, atom penerima elektron menjadi bermuatan negatif dan disebut anion. Daya tarik elektrostatik muncul antara kation ini dan anion karena muatan listrik yang berlawanan. Perbedaan besar dalam elektronegativitas antara kedua atom menyebabkan ikatan ini terjadi. Baik atom logam dan non-logam terlibat dalam ikatan ini.
Namun, tidak ada ikatan elektrovalen yang merupakan ikatan ionik murni. Masing -masing dan setiap senyawa ionik mungkin memiliki beberapa persentase ikatan kovalen. Dengan demikian, ia mengungkapkan bahwa senyawa ionik memiliki karakter ionik yang lebih besar dan tingkat karakter kovalen yang rendah. Tetapi ada beberapa senyawa dengan tingkat karakter kovalen yang cukup besar. Jenis ikatan itu disebut ikatan kovalen kutub.
Karakteristik senyawa yang dibangun dari ikatan elektrovalen berbeda dari senyawa yang dibangun dari ikatan kovalen. Saat mempertimbangkan sifat fisik, biasanya titik didih yang lebih tinggi dan titik leleh dapat diamati. Tetapi kelarutan dalam air dan sifat konduktivitas listrik sangat tinggi. Contoh senyawa dengan ikatan ionik mungkin termasuk halida logam, oksida logam, sulfida logam, dll.
Gambar 01: ikatan elektrovalen
Apa itu ikatan kovalen?
Ikatan kovalen adalah jenis ikatan kimia yang dibentuk sebagai hasil dari berbagi pasangan elektron antara atom non-logam. Berbagi elektron ini terjadi karena perbedaan elektronegativitas yang rendah antara dua atom yang terlibat dalam ikatan. Dalam ikatan kovalen, atom non-logam biasanya terlibat. Atom -atom ini memiliki konfigurasi elektron yang tidak lengkap di orbital luarnya, dengan demikian, berbagi elektron yang tidak berpasangan untuk mencapai konfigurasi elektron yang mirip dengan gas mulia. Itu karena konfigurasi elektron yang tidak lengkap membuat atom tertentu tidak stabil. Tidak seperti ikatan ionik, ikatan kovalen mungkin memiliki ikatan tunggal, rangkap atau ikatan rangkap tiga antara dua atom. Ikatan ini terbentuk sedemikian rupa sehingga kedua atom mematuhi aturan oktet. Ikatan terjadi melalui tumpang tindih orbital atom. Satu ikatan terbentuk saat dua elektron dibagikan. Ikatan rangkap terbentuk saat empat elektron dibagikan. Berbagi enam elektron dapat menghasilkan ikatan rangkap tiga.
Karakteristik senyawa dengan ikatan kovalen termasuk ikatan yang kuat antara dua atom karena nilai elektronegativitas yang sama. Dengan demikian, kelarutan dan konduktivitas listrik (dalam keadaan larut) buruk atau tidak ada. Senyawa ini juga memiliki titik leleh yang lebih rendah dan titik didih dibandingkan dengan senyawa ionik. Sejumlah senyawa organik dan anorganik dapat diambil sebagai contoh senyawa dengan ikatan kovalen.
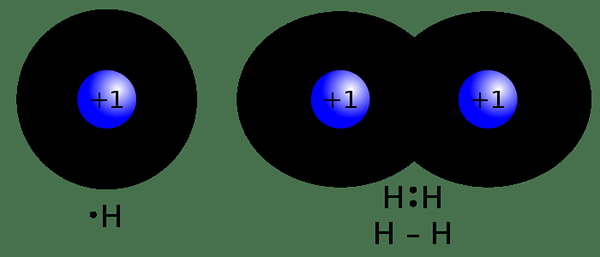
Gambar 02: ikatan kovalen
Apa perbedaan antara ikatan elektrovalen dan ikatan kovalen?
Ikatan elektrovalen vs ikatan kovalen | |
| Ikatan elektrovalen adalah ikatan kimia antara dua atom karena transfer elektron dari satu atom ke atom lainnya. | Ikatan kovalen adalah jenis ikatan kimia yang terjadi karena berbagi pasangan elektron antar atom. |
| Logam vs non-logam | |
| Ikatan elektrovalen dapat diamati antara logam dan non-logam. | Ikatan kovalen biasanya dapat diamati antara dua non-logam. |
| Perbedaan elektronegativitas | |
| Perbedaan elektronegativitas antara dua atom lebih tinggi dalam ikatan elektrovalen. | Perbedaan elektronegativitas antara dua atom relatif lebih rendah. |
| Kelarutan dalam air dan konduktivitas listrik | |
| Kelarutan dalam air dan konduktivitas listrik lebih tinggi pada senyawa dengan ikatan elektrovalen. | Kelarutan dalam air dan konduktivitas listrik relatif lebih rendah dalam senyawa dengan ikatan kovalen. |
| Titik mendidih dan meleleh | |
| Titik mendidih dan leleh lebih tinggi untuk ikatan elektrovalen. | Titik mendidih dan leleh relatif lebih rendah untuk ikatan kovalen. |
Ringkasan -ikatan elektrovalen vs kovalen
Ikatan elektrovalen dan kovalen adalah dua jenis ikatan kimia yang berbeda satu sama lain. Perbedaan utama antara ikatan elektrovalen dan kovalen adalah sifatnya; Ikatan elektrovalen adalah jenis daya tarik elektrostatik antara dua atom sedangkan ikatan kovalen berbagi pasangan elektron antara dua atom.
Referensi:
1. “Ikatan elektrovalen."Emedicalprep. N.P., N.D. Web. 25 Mei 2017.<>
2."Ikatan kovalen .“Kelompok Divisi Pendidikan Kimia. Universitas Purdue, n.D. Web. 25 Mei 2017.<>
3."Ikatan kimia.Khan Academy, n.D. Web. 25 Mei 2017. <>
Gambar milik:
1. “NaCl Ionic Bond” oleh Mhowison - karya sendiri (domain publik) melalui Commons Wikimedia
2. “Kovalen Bond Hydrogen” oleh Jacek FH - Karya Sendiri (CC BY -SA 3.0) Via Commons Wikimedia


