Perbedaan antara eliminasi dan reaksi substitusi
Perbedaan utama - reaksi eliminasi vs substitusi
Reaksi eliminasi dan substitusi adalah dua jenis reaksi kimia yang terutama ditemukan dalam kimia organik. Itu perbedaan utama Antara eliminasi dan reaksi substitusi dapat dijelaskan dengan menggunakan mekanismenya. Dalam reaksi eliminasi, penataan ulang ikatan sebelumnya terjadi setelah reaksi, sedangkan reaksi substitusi menggantikan kelompok yang meninggalkan dengan nukleofil. Dua reaksi ini saling bersaing dan dipengaruhi oleh beberapa faktor lainnya. Kondisi tersebut bervariasi dari satu reaksi ke yang lain.
Apa reaksi eliminasi?
Reaksi eliminasi ditemukan dalam kimia organik, dan mekanismenya melibatkan penghapusan dua substituen dari molekul organik baik dalam satu langkah atau dua langkah. Ketika reaksi terjadi dalam mekanisme langkah tunggal, ia dikenal sebagai Reaksi E2 (Reaksi Bi-Molekul), dan ketika memiliki mekanisme dua langkah, ia dikenal sebagai Reaksi E1 (reaksi unimolekul). Secara umum, sebagian besar reaksi eliminasi melibatkan hilangnya setidaknya satu atom hidrogen untuk membentuk ikatan rangkap. Ini meningkatkan ketidakjenuhan molekul.

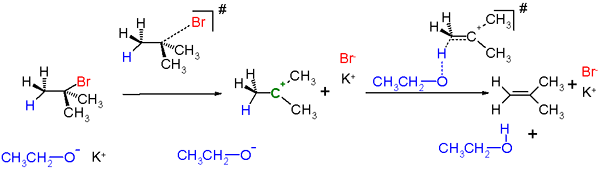
Reaksi e1
Apa itu reaksi substitusi?
Reaksi substitusi adalah jenis reaksi kimia yang melibatkan penggantian satu kelompok fungsional dalam senyawa kimia oleh kelompok fungsional lain. Reaksi substitusi juga dikenal sebagai 'reaksi perpindahan tunggal' atau 'reaksi penggantian tunggal.'Reaksi ini sangat penting dalam kimia organik, dan mereka terutama diklasifikasikan menjadi dua kelompok, berdasarkan reagen yang terlibat dalam reaksi: reaksi substitusi elektrofilik dan reaksi substitusi nukleofilik. Dua jenis reaksi substitusi ini ada sebagai sN1 reaksi dan sN2 reaksi.
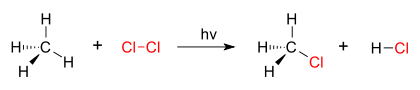
Reaksi substitusi -klorinasi metana
Apa perbedaan antara eliminasi dan reaksi substitusi?
Mekanisme:
Reaksi eliminasi: Reaksi eliminasi dapat dibagi menjadi dua kategori; Reaksi E1 dan reaksi E2. Reaksi E1 memiliki dua langkah dalam reaksi, dan reaksi E1 memiliki mekanisme langkah tunggal.
Reaksi Substitusi: Reaksi substitusi dibagi menjadi dua kategori berdasarkan mekanisme reaksi mereka: sN1 reaksi danN2 reaksi.
Properti:
Reaksi eliminasi:
E1 Reaksi: Reaksi-reaksi ini bersifat non-stereospesifik, dan mereka mengikuti aturan Zaitsev (Saytseff). Intermediate karbokation terbentuk dalam reaksi sehingga reaksi ini adalah reaksi yang tidak terkonsekuensi. Mereka adalah reaksi unimolekul karena laju reaksi hanya tergantung pada konsentrasi. Reaksi ini tidak terjadi dengan alkil primer halida (kelompok meninggalkan). Asam kuat mampu mempromosikan hilangnya oh sebagai h2O atau atau sebagai hor jika karbokasi tersier atau terkonjugasi dapat dibentuk sebagai perantara.
E2 Reaksi: Reaksi ini stereospesifik; Geometri anti-periplanar lebih disukai, tetapi geometri synperiplanar juga dimungkinkan. Mereka dipastikan dan dianggap sebagai reaksi bimolekul karena laju reaksi tergantung pada konsentrasi basa dan substrat. Reaksi ini disukai oleh basis yang kuat.
Reaksi Substitusi:
SN1 Reaksi: Reaksi ini dikatakan non-stereospesifik karena nukleofil dapat menyerang molekul dari kedua sisi. Karbokasi yang stabil terbentuk dalam reaksi dan oleh karena itu reaksi ini adalah reaksi yang tidak dipastikan. Laju reaksi hanya tergantung pada konsentrasi substrat, dan mereka disebut reaksi unimolekul.
SN2 Reaksi: Reaksi ini stereospesifik dan terpadu. Laju reaksi tergantung pada konsentrasi nukleofil dan substrat. Reaksi ini sangat terjadi, ketika nukleofil lebih reaktif (lebih anionik atau dasar).
Definisi:
Stereospecific:
Dalam reaksi kimia, produksi bentuk stereomerik produk tertentu, terlepas dari konfigurasi reaktan.
Reaksi bersama:
Reaksi bersama adalah reaksi kimia di mana semua ikatan pecah dan terbentuk dalam satu langkah.
Referensi: “Reaksi Eliminasi.”Wikipedia. Diakses 13 September 2016. Di sini “Reaksi Substitusi.”Wikipedia. Diakses 13 September 2016. Di sini “Substitusi dan reaksi eliminasi.”Khan Academy. Diakses 13 September 2016. Di sini “Menu Mekanisme Eliminasi.”ChemGuide. Diakses 13 September 2016. Di sini “Substitusi Nukleofilik."Pendidikan McGraw-Hill. Diakses 13 September 2016. Di Sini “Sn2, Sn1, E2, & E1: Reaksi substitusi dan eliminasi.”PDF. Di Sini Gambar milik: “E1 Elimination Reaction” oleh V8Rik di Wikipedia Bahasa Inggris (CC BY-SA 3.0) Via Commons Wikimedia "Reaksi Substitusi" oleh V8Rik di Inggris Wikipedia (CC BY-SA 3.0) Via Commons Wikimedia

