Perbedaan antara entalpi dan panas
Itu perbedaan utama antara entalpi dan panas adalah itu Enthalpy adalah jumlah panas yang ditransfer selama reaksi kimia pada tekanan konstan sedangkan panas adalah bentuk energi.
Untuk tujuan studi dalam kimia, kami membagi alam semesta menjadi dua: sistem dan sekitarnya. Sistem adalah subjek investigasi kami saat sisanya adalah sekitarnya. Panas dan entalpi adalah dua istilah yang menggambarkan aliran energi dan sifat -sifat suatu sistem.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa entalpi
3. Apa itu panas
4. Perbandingan berdampingan -entalpi vs panas dalam bentuk tabel
5. Ringkasan
Apa entalpi?
Dalam termodinamika, energi total suatu sistem adalah energi internal. Energi internal menentukan total energi kinetik dan potensial molekul dalam sistem. Energi internal suatu sistem dapat diubah baik dengan melakukan pekerjaan pada sistem, atau memanaskannya. Namun, perubahan energi internal tidak sama dengan energi yang ditransfer sebagai panas ketika sistem mampu mengubah volumenya.
Enthalpy adalah properti termodinamika dan kami dapat menyatakannya dengan h. Hubungan matematika untuk istilah ini adalah sebagai berikut:
H = u + pv
Di sini, H adalah entalpi dan U adalah energi internal, p adalah tekanan dan v adalah volume sistem. Persamaan ini menunjukkan bahwa energi yang dipasok sebagai panas pada tekanan konstan sama dengan perubahan entalpi. Istilah PV memperhitungkan energi yang dibutuhkan oleh sistem untuk mengubah volume terhadap tekanan konstan. Oleh karena itu, entalpi pada dasarnya adalah panas dari reaksi pada tekanan konstan.

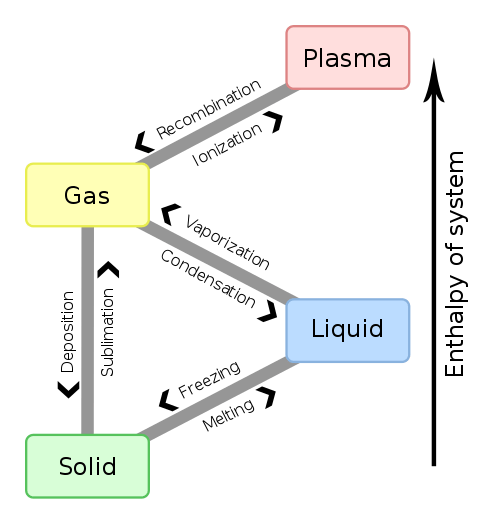
Gambar 01: Perubahan entalpi untuk perubahan fase materi
Selain itu, perubahan entalpi (∆H) untuk reaksi dalam suhu dan tekanan tertentu diperoleh dengan mengurangi entalpi reaktan dari entalpi produk. Jika nilai ini negatif, maka reaksinya eksotermik. Jika nilainya positif, maka reaksinya dikatakan endotermik. Perubahan entalpi antara setiap reaktan dan produk tidak tergantung pada jalur di antara mereka. Selain itu, perubahan entalpi tergantung pada fase reaktan. Misalnya, ketika gas oksigen dan hidrogen bereaksi untuk menghasilkan uap air, perubahan entalpi adalah -483.7 kJ. Tapi, ketika reaktan yang sama bereaksi untuk menghasilkan air cair, perubahan entalpi adalah -571.5 kJ.
Apa itu panas?
Kapasitas sistem untuk melakukan pekerjaan adalah energi dari sistem itu. Kita dapat melakukan pekerjaan pada sistem atau sistem dapat melakukan pekerjaan, yang mengarah pada meningkatkan atau mengurangi energi sistem yang sesuai. Energi suatu sistem dapat diubah, tidak hanya dengan pekerjaan itu sendiri, dengan cara lain juga. Ketika energi suatu sistem berubah sebagai akibat dari perbedaan suhu antara sistem dan lingkungannya, kami merujuk pada energi yang ditransfer sebagai panas (q); yaitu energi telah ditransfer sebagai panas.

Perpindahan panas terjadi dari suhu tinggi ke suhu rendah, yang menurut gradien suhu. Selain itu, proses ini berlanjut hingga suhu antara sistem dan sekitarnya mencapai level yang sama. Ada dua jenis proses transfer panas. Mereka adalah proses endotermik dan proses eksotermik. Proses endotermik adalah proses di mana energi memasuki sistem dari lingkungan sebagai panas sementara proses eksotermik adalah proses di mana panas ditransfer dari sistem ke lingkungan sebagai panas.
Apa perbedaan antara entalpi dan panas?
Sebagian besar dari waktu, kami menggunakan istilah entalpi dan panas secara bergantian, tetapi ada sedikit perbedaan antara entalplay dan panas. Perbedaan utama antara entalpi dan panas adalah entalpi menggambarkan jumlah panas yang ditransfer selama reaksi kimia pada tekanan konstan sedangkan panas adalah bentuk energi. Selain itu, entalpi adalah fungsi dari keadaan, sedangkan panas tidak karena panas bukanlah sifat intrinsik dari suatu sistem. Selain itu, kami tidak dapat mengukur entalpi secara langsung, jadi kami harus menghitungnya melalui persamaan; Namun, kita dapat mengukur panas secara langsung sebagai perubahan suhu.
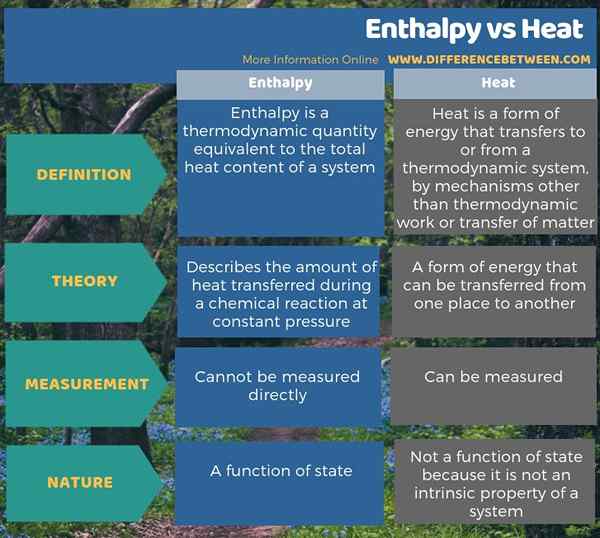
Ringkasan -Enthalpy vs Heat
Kami sering menggunakan istilah entalpi dan panas secara bergantian, tetapi ada sedikit perbedaan entalpi dan panas adalah bahwa entalpi menggambarkan jumlah panas yang ditransfer selama reaksi kimia pada tekanan konstan sedangkan panas adalah bentuk energi.
Referensi:
1. Helmenstine, Anne Marie. “Definisi entalpi dalam kimia dan fisika."Thoughtco, Aug. 22, 2019, tersedia di sini
Gambar milik:
1. “Perubahan fase - en.”Oleh F L A N K E R, Penubag - Pekerjaan Sendiri (Domain Publik) Via Commons Wikimedia
2. “Fire Flare-Up Heat Free Picture” (CC0) melalui Needpix.com


