Perbedaan antara titik nyala dan titik didih

Itu perbedaan utama antara titik nyala dan titik didih adalah bahwa Istilah titik nyala diterapkan untuk cairan volatil, sedangkan titik didih istilah dapat diterapkan untuk cairan apa pun.
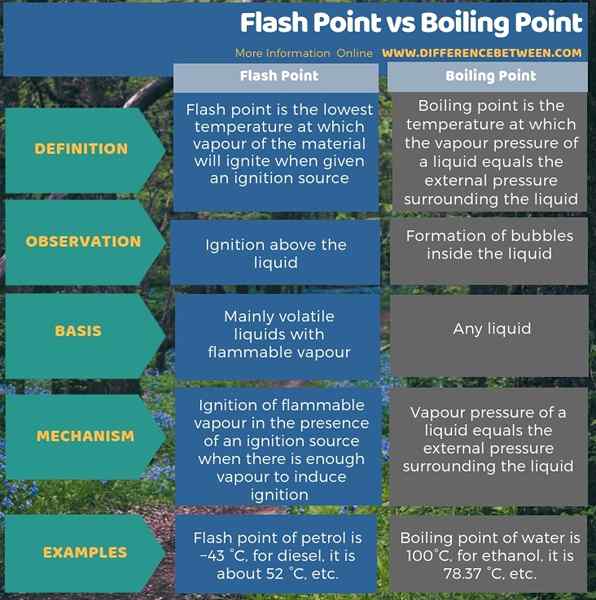
Titik nyala dan titik didih adalah dua istilah yang kami gunakan mengenai keadaan cair zat. Flashpoint secara khusus berlaku untuk cairan volatil karena merupakan suhu terendah di mana uap cairan volatil dapat menjalani pengapian. Di sisi lain, titik didih adalah suhu di mana tekanan uap cairan sama dengan tekanan eksternal di sekitar cairan. Setiap cairan memiliki titik didih, tetapi hanya cairan yang mudah menguap yang memiliki titik nyala.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Titik Flash
3. Apa itu titik didih
4. Perbandingan berdampingan - titik nyala vs titik didih dalam bentuk tabel
5. Ringkasan
Apa itu Titik Flash?
Titik nyala adalah suhu terendah di mana uap bahan akan terbakar saat diberi sumber pengapian. Kami sering bingung dengan titik api dan titik nyala, berpikir keduanya sama. Tapi, titik api memberikan suhu terendah di mana uap suatu zat dapat terus membakar ketika kita menghilangkan sumber pengapian, yang sama sekali berbeda dari definisi titik nyala.

Gambar 01: Koktail menyala dengan titik nyala yang lebih rendah dari suhu kamar
Saat mempertimbangkan pengapian uap, pada titik nyala, ada cukup uap untuk menginduksi pengapian saat kita memasok sumber pengapian. Cairan yang mudah menguap memiliki konsentrasi unik uap yang mudah terbakar, yang diperlukan untuk mempertahankan pembakaran di udara.
Jika kita ingin mengukur titik nyala suatu zat, ada dua metode: pengukuran cangkir terbuka dan pengukuran cangkir tertutup. Selain itu, metode penentuan titik nyala ditentukan dalam banyak standar.
Apa itu titik didih?
Titik didih adalah suhu di mana tekanan uap cairan menjadi sama dengan tekanan eksternal di sekitar cairan. Oleh karena itu, titik didih tergantung pada tekanan atmosfer. Di sini, kita dapat mengamati titik didih yang lebih tinggi pada tekanan eksternal yang lebih tinggi. Biasanya, air mendidih 1000C. Karena tekanan atmosfer lebih rendah pada ketinggian yang lebih tinggi, air akan mendidih antara 80 0C - 90 0C. Ini akan menyebabkan makanan yang kurang matang.

Gambar 02: Air mendidih
Boiling cairan terjadi ketika suhu cairan melebihi suhu saturasi pada tekanan saturasi yang sesuai. Suhu saturasi adalah suhu yang sesuai dengan energi termal tertinggi yang dapat dipegang cairan tanpa mengubah keadaannya menjadi uap pada tekanan yang diberikan. Suhu saturasi juga setara dengan titik didih cairan. Boiling terjadi ketika energi termal cairan cukup untuk memecahkan ikatan antarmolekul. Titik didih normal adalah suhu saturasi pada tekanan atmosfer. Titik didih hanya bervariasi antara titik tiga dan titik kritis cairan.
Apa perbedaan antara titik nyala dan titik didih?
Titik nyala adalah suhu terendah di mana uap bahan akan terbakar saat diberi sumber pengapian. Titik didih adalah suhu di mana tekanan uap cairan sama dengan tekanan eksternal di sekitar cairan. Jadi, perbedaan utama antara titik nyala dan titik didih adalah bahwa setiap cairan memiliki titik didih, tetapi hanya cairan yang mudah menguap memiliki titik nyala.
Selain itu, pada titik nyala cairan, kita dapat mengamati pengapian di atas cairan saat pada titik didih, kita dapat mengamati pembentukan gelembung di dalam cairan. Oleh karena itu, ini adalah perbedaan penting antara titik nyala dan titik didih. Jika kita melihat mekanisme mereka, pengapian uap yang mudah terbakar terjadi di hadapan sumber pengapian pada titik nyala, ketika ada cukup uap untuk menginduksi pengapian. Namun, pada titik didih, tekanan uap cairan menjadi sama dengan tekanan eksternal di sekitar cairan.
Ringkasan -Titik Flash vs Boiling Point
Titik nyala dan titik didih memiliki beberapa perbedaan penting di antara mereka. Perbedaan utama antara titik nyala dan titik didih adalah bahwa istilah titik nyala diterapkan untuk cairan yang mudah menguap, sedangkan istilah titik didih dapat diterapkan untuk cairan apa pun.
Referensi:
1. Helmenstine, Anne Marie. “Definisi titik didih dalam kimia."Thoughtco, May. 7, 2019, tersedia di sini.
2. "Titik didih.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 Feb. 2018, tersedia di sini.
Gambar milik:
1. "Flaming Cocktails" oleh Nik Frey (Niksan) - (CC oleh 2.5) Via Commons Wikimedia
2. "194034" (CC0) via pexels


