Perbedaan antara tingkat instan dan tingkat rata -rata
Perbedaan Utama - Tingkat Instan vs Tingkat Rata -Rata
Dalam reaksi kimia, laju reaksi dapat ditentukan dalam dua cara sebagai laju instan dan laju rata -rata. Perbedaan utama antara tingkat instan dan tingkat rata -rata adalah Laju sesaat mengukur perubahan konsentrasi reaktan atau produk selama periode waktu yang diketahui sedangkan laju rata -rata mengukur perubahan konsentrasi reaktan atau produk selama seluruh waktu yang diambil untuk penyelesaian reaksi kimia.
Laju reaksi reaksi kimia adalah ukuran perubahan konsentrasi reaktan yang digunakan atau produk yang terbentuk selama reaksi. Itu juga dikenal sebagai kecepatan reaksi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa tarif instan
3. Berapa tarif rata -rata
4. Perbandingan berdampingan - laju instan vs laju rata -rata dalam bentuk tabel
5. Ringkasan
Apa tarif instan?
Laju sesaat adalah laju reaksi kimia yang diukur sebagai perubahan konsentrasi reaktan atau produk selama periode waktu yang diketahui. Dalam metode ini, laju reaksi selama instan tertentu dalam waktu diukur. Itu juga dapat diukur sebagai laju reaksi pada saat tertentu. Tingkat sesaat juga dikenal sebagai tingkat diferensial.
Laju reaksi reaksi kimia seringkali berbeda dari satu titik ke titik lain selama perkembangan reaksi (perubahan laju reaksi terus menerus). Laju reaksi melambat saat reaktan digunakan untuk reaksi. Ini karena konsentrasi reaktan berkurang dengan perkembangan reaksi (reaktan dikonsumsi oleh reaksi kimia).
Tingkat Perubahan Rumus Instan
Tingkat sesaat diberikan seperti di bawah ini.
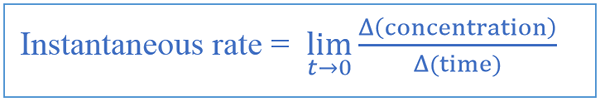

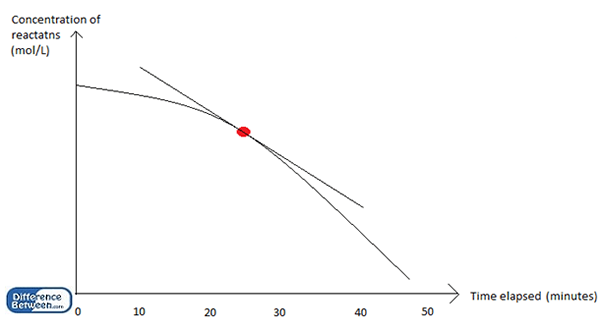
Grafik di atas menunjukkan penurunan konsentrasi reaktan dengan waktu dalam reaksi kimia; Laju sesaat adalah laju reaksi pada titik tertentu (titik berwarna merah); Laju rata -rata dihitung dengan membagi konsentrasi total reaktan (pada awal) dari total waktu (50 menit).
Berapa tarif rata -rata?
Laju rata -rata adalah laju reaksi kimia yang diukur sebagai perubahan konsentrasi reaktan atau produk selama periode waktu perkembangan reaksi kimia. Laju reaksi berbeda dari satu titik tertentu ke titik lain selama perkembangan reaksi kimia karena laju reaksi berubah terus menerus. Tetapi tingkat rata -rata memberikan tingkat rata -rata semua poin ini, tetapi tidak memberikan informasi tentang titik di antara inisiasi dan penyelesaian reaksi.
Tingkat Rata -rata Perubahan Formula
Tingkat perubahan rata -rata diberikan seperti di bawah ini.
Laju rata -rata = Δ (konsentrasi reaktan atau produk) /δ (waktu)
Laju rata -rata hanya memberikan laju rata -rata reaksi keseluruhan, tetapi laju rata -rata ini bukan laju aktual di seluruh reaksi karena laju reaksi menurun dengan konsumsi reaktan.
Apa perbedaan antara tingkat instan dan tingkat rata -rata?
Tingkat instan vs tingkat rata -rata | |
| Laju sesaat adalah laju reaksi kimia yang diukur sebagai perubahan konsentrasi reaktan atau produk selama periode waktu yang diketahui. | Laju rata -rata adalah laju reaksi kimia yang diukur sebagai perubahan konsentrasi reaktan atau produk selama periode waktu perkembangan reaksi kimia. |
| Waktu | |
| Tingkat sesaat diukur untuk momen tertentu atau untuk periode waktu yang sangat singkat. | Tingkat rata -rata diukur untuk jangka waktu yang lebih lama. |
| Formula untuk perhitungan | |
| Laju perubahan instan = lim (t → 0) [Δ (konsentrasi reaktan atau produk) /Δ (waktu)] | Laju perubahan rata -rata = δ (konsentrasi reaktan atau produk) /δ (waktu) |
Ringkasan - Tingkat Instan vs Tingkat Rata -Rata
Laju reaksi reaksi kimia adalah laju perubahan konsentrasi baik reaktan atau produk. Laju reaksi dapat ditentukan dalam dua bentuk sebagai laju instan dan laju rata -rata. Perbedaan utama antara laju instan dan laju rata -rata adalah bahwa laju instan mengukur perubahan konsentrasi reaktan atau produk selama periode waktu yang diketahui sedangkan laju rata -rata mengukur perubahan konsentrasi reaktan atau produk selama seluruh waktu untuk menyelesaikan penyelesaian dari reaksi kimia.
Referensi:
1. Laidler, Keith J. "Laju reaksi.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 23 Apr. 2014, tersedia di sini.
2. “Menemukan laju perubahan instan." Belajar.com, tersedia di sini.
3. Libretexts. "Laju reaksi.”Kimia Libretexts, Libretexts, 21 Juli 2016, tersedia di sini.


