Perbedaan antara iodometri dan iodimetri

Itu perbedaan utama Antara iodometri dan iodimetri adalah itu kita dapat menggunakan iodometri untuk mengukur agen pengoksidasi, sedangkan kita dapat menggunakan iodimetri untuk mengukur agen pereduksi.
Iodometri dan iodimetri adalah dua metode titrasi umum yang berguna dalam kimia analitik. Dasar dari dua jenis titrasi ini adalah pengurangan oksidasi, dan kita dapat menggunakannya untuk menentukan spesies redoks secara kuantitatif. Dasar titrasi adalah reaksi antara analit dan reagen standar yang dikenal sebagai titrant. Kita dapat menentukan kuantitas analit jika kita tahu reaksi, stoikiometri dan volume/massa titran yang diperlukan untuk bereaksi sepenuhnya dengan analit. Selain itu, kita dapat menggunakan yodium untuk titrasi redoks ini karena kemampuannya bereaksi cepat dengan banyak spesies. Reversibilitas yodium/iodida, reaksinya juga merupakan keuntungan saat menggunakannya dalam reaksi iodometrik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu iodometri
3. Apa itu iodimetri
4. Perbandingan berdampingan - iodometri vs iodimetri dalam bentuk tabel
5. Ringkasan
Apa itu iodometri?
Dalam iodometri, iodida bereaksi dengan zat pengoksidasi lain dalam media asam atau medium netral. Ketika reaksi ini terjadi, iodida (kami menambahkan iodida dalam bentuk ki) teroksidasi menjadi yodium dan spesies lainnya akan mengalami pengurangan oleh iodida. Lalu kita dapat melakukan titrasi yodium yang dilepaskan dengan spesies lain. Spesies titrasi ini adalah solusi standar dari agen pereduksi, yang mampu mengurangi yodium kembali ke bentuk iodida. Biasanya, kami menggunakan solusi tiosulfat standar untuk ini. Misalnya, jika kita ingin mengukur jumlah klorin yang dilarutkan dalam campuran, berikut ini adalah metode untuk melakukan titrasi iodometrik.
Pertama, kita harus mengambil jumlah volume yang diketahui dari campuran (di mana klorin dilarutkan) ke dalam labu titrasi. Kemudian kita dapat melakukan titonya dengan solusi KI yang diketahui, dan kita dapat menemukan volume yang dikonsumsi.
Mengikuti reaksi redoks akan terjadi dalam labu reaksi;
Cl2 + 2i- -> 2 Cl- + SAYA2

Gambar 01: Perubahan warna dalam iodometri
Maka kita harus melakukan titrasi lain dengan campuran yang sama untuk menentukan jumlah yodium yang dilepaskan. Untuk ini, kita dapat melakukan titrasi campuran dengan larutan tiosulfat standar. Kita perlu menambahkan pati sebagai indikator, untuk menentukan titik akhir reaksi ini. Dengan yodium dan pati dalam campuran, itu akan muncul dalam warna biru tua, tetapi pada titik akhir ketika semua yodium selesai, warna gelap akan hilang.
SAYA2 + 2 s2HAI32− → s4HAI62− + 2 i-
Dari dua titrasi di atas, kita dapat menentukan jumlah CL2.
Apa itu iodimetri?
Dalam iodimetri, menggunakan yodium gratis untuk menjalani titrasi dengan agen pereduksi. Oleh karena itu, yodium berkurang menjadi iodida, dan yodium akan mengoksidasi spesies lain.

Gambar 02: Melakukan titrasi
Karena kami tidak dapat dengan mudah menyiapkan larutan yodium gratis, kami harus mencampur yodium dengan kalium iodida dan ki3 Solusi untuk menyiapkan solusi yang diperlukan. Dan solusi standar ini digunakan untuk titrasi iodometrik.
Ki+i2 → Ki3
Reaksi berikut terjadi saat titrasi. Kita bisa menggunakan pati sebagai indikator untuk titrasi iodometrik juga.
SAYA2 + agen pereduksi → 2 i-
Apa perbedaan antara iodometri dan iodimetri?
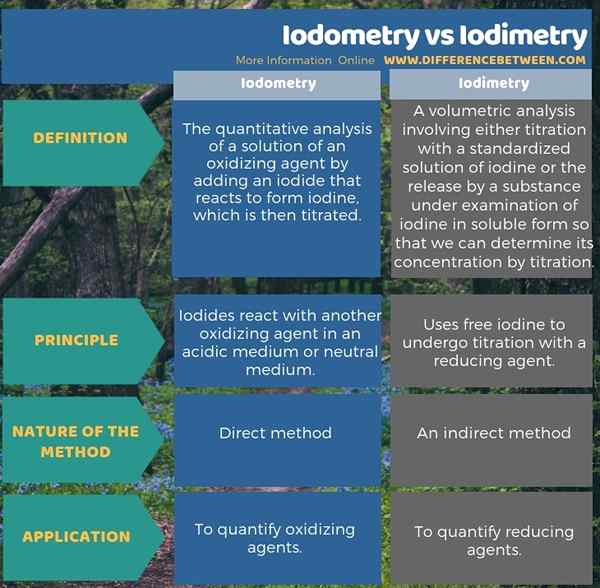
Iodometri adalah analisis kuantitatif dari larutan agen pengoksidasi dengan menambahkan iodida yang bereaksi membentuk yodium, yang kemudian dititrasi sedangkan iodimetri adalah analisis volumetrik yang melibatkan titrasi dengan larutan yodium standar, atau pelepasan dengan substansi yang diuji yodium dalam bentuk terlarut, sehingga kita dapat menentukan konsentrasinya dengan titrasi. Ini adalah salah satu perbedaan antara iodometri dan iodimetri.
Selain itu, perbedaan lain antara iodometri dan iodimetri adalah bahwa, dalam iodometri, iodida bereaksi dengan zat pengoksidasi lain dalam media asam atau medium netral saat dalam iodimetri, ia menggunakan yodium bebas untuk menjalani titrasi dengan agen pereduksi.
Infografis di bawah ini menyajikan perbedaan antara iodometri dan iodimetri dalam bentuk tabel.
Ringkasan -iodometri vs iodimetri
Meskipun dua istilah iodometri dan iodimetri terdengar serupa, mereka adalah dua teknik berbeda yang kami gunakan dalam kimia analitik. Perbedaan utama antara iodometri dan iodimetri adalah bahwa kita dapat menggunakan iodometri untuk mengukur agen pengoksidasi, sedangkan kita dapat menggunakan iodimetri untuk mengukur agen pereduksi.
Referensi:
1. “Iodometri."Wikipedia, Wikimedia Foundation, 9 September. 2018. Tersedia disini
2. Naviglio, Daniele. “Iodometri dan iodimetri, Daniele Naviglio" Kimia Analitik "Agraria" Federica E-Learning.”Federica, Pembelajaran Web Federica, Università di Napoli Federico II, 20 Mar. 2012. Tersedia disini
Gambar milik:
1."Campuran titrasi iodometrik" oleh lhchem - karya sendiri, (cc by -sa 3.0) Via Commons Wikimedia
2."Demonstrasi titrasi tingkat sekolah" oleh UCL - Flickr, (CC oleh 2.0) Via Commons Wikimedia


