Perbedaan antara ion dipol dan pasukan dipol dipol

Perbedaan utama - ion dipol vs Dipol Pasukan dipol
Kekuatan antarmolekul adalah gaya tarik yang ada di antara molekul yang berbeda. Kekuatan Ion-Dipole dan Gaya Dipole-Dipole adalah dua bentuk gaya antarmolekul. Beberapa contoh lain untuk gaya antarmolekul termasuk gaya dipol yang diinduksi ion, ikatan hidrogen, dan gaya van der Waal. Gaya -gaya ini adalah atraksi elektrostatik karena molekulnya tertarik berdasarkan muatan listriknya. Itu perbedaan utama Antara pasukan ion-dipol dan dipol-dipol adalah itu Kekuatan ion-dipol ada antara spesies ionik dan molekul kutub sedangkan gaya dipol-dipol ada di antara molekul kutub.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu kekuatan dipol ion
3. Apa itu kekuatan dipol dipol
4. Kesamaan antara ion dipol dan pasukan dipol dipol
5. Perbandingan berdampingan - Ion dipol vs dipol dipol dalam bentuk tabel
6. Ringkasan
Apa itu kekuatan dipol ion?
Kekuatan ion-dipol adalah gaya tarik antara spesies ionik dan molekul kutub.Spesies ionik dapat berupa anion (spesies bermuatan negatif) atau kation (spesies bermuatan positif).Molekul kutub adalah molekul apa pun yang memiliki pemisahan muatan listrik permanen dalam molekul karena perbedaan antara nilai elektronegativitas atom dalam molekul tersebut. Elektronegativitas adalah kemampuan untuk menarik elektron. Ketika sebuah atom yang memiliki elektronegativitas tinggi terikat pada atom yang memiliki elektronegativitas rendah, elektron ikatan tertarik dengan atom yang memiliki elektronegativitas tinggi (maka ia mendapat muatan negatif parsial), memberikan atom elektronegatif yang lebih sedikit muatan positif parsial parsial positif parsial) parsial). Keadaan pemisahan muatan ini disebut polarisasi dan molekul disebut molekul kutub.
Kekuatan Ion-Dipole lebih kuat dari kekuatan dipol-dipol. Itu karena jenis gaya antarmolekul ini melibatkan spesies ionik yang memiliki muatan listrik yang lebih tinggi dibandingkan dengan molekul kutub. Gaya ion-dipol bahkan lebih kuat dari ikatan hidrogen. Interaksi ini terjadi karena interaksi elektrostatik antara ion dan dipol.
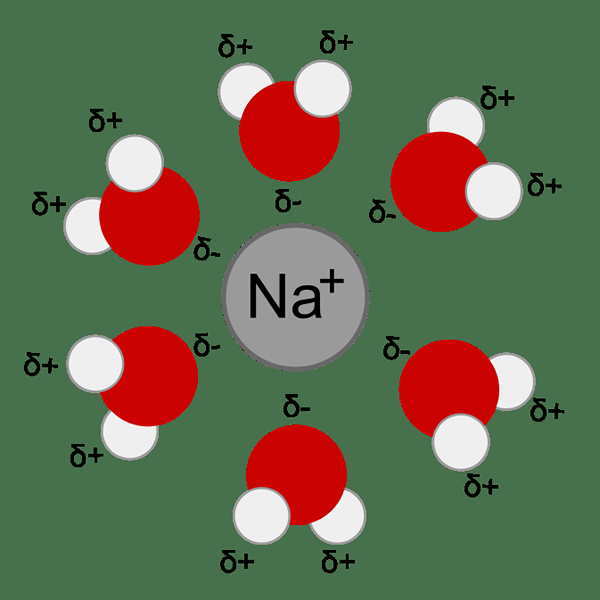
Gambar 01: Hidrasi ion logam terjadi karena daya tarik antara ion logam dan molekul air (dipol)
Subkategori gaya ion-dipol adalah gaya dipol yang diinduksi ion yang melibatkan molekul nonpolar, bukan molekul polar. Molekul nonpolar tidak memiliki dipol (tanpa pemisahan muatan). Muatan ion menyebabkan molekul nonpolar terpolarisasi dengan mendistorsi awan elektron molekul nonpolar.
Apa itu kekuatan dipol dipol?
Gaya dipol-dipol adalah gaya antarmolekul yang terjadi antara molekul kutub. Ini adalah gaya elektrostatik. Saat membentuk jenis gaya ini, molekul kutub cenderung diselaraskan sehingga daya tarik antara molekul dimaksimalkan dengan mengurangi energi potensial. Penyelarasan ini juga mengurangi tolakan antara molekul.

Gambar 02: Gaya tarik antara molekul HCl polar
Ketika serangkaian senyawa dengan massa molar yang serupa dipertimbangkan (yang memiliki kekuatan interaksi dipol-dipol antara molekul), kekuatan gaya dipol-dipol meningkat seiring meningkatnya polaritas polaritas. Itu terjadi karena ketika polaritas tinggi, itu berarti pemisahan muatan tinggi. Ketika molekul memiliki pemisahan muatan tinggi (terminal positif dan negatif bermuatan tinggi dalam molekul yang sama), ia cenderung sangat menarik muatan yang berlawanan. Ini juga menyebabkan meningkatkan titik didih senyawa. Lebih besar gaya dipol-dipol, lebih besar titik didih.
Apa kesamaan antara ion dipol dan pasukan dipol dipol?
- Baik Ion Dipole dan Dipole Dipole adalah jenis interaksi antarmolekul
- Baik Ion Dipole dan Dipole Dipole Gaya adalah gaya elektrostatik
Apa perbedaan antara ion dipol dan pasukan dipol dipol?
Ion Dipole vs Dipole Dipole Forces | |
| Kekuatan dipol ion adalah kekuatan yang menarik antara spesies ionik dan molekul kutub. | Gaya dipol-dipol adalah gaya antarmolekul yang terjadi antara molekul kutub. |
| Kekuatan | |
| Gaya ion-dipol lebih kuat dari ikatan hidrogen dan gaya dipol-dipol. | Gaya dipol dipol lebih lemah dari ikatan hidrogen dan gaya ion-dipol. |
| Komponen | |
| Kekuatan ion-dipol muncul antara ion (kation atau anion) dan molekul kutub. | Gaya dipol-dipol muncul di antara molekul kutub. |
Ringkasan - Ion dipol vs Dipol Pasukan dipol
Kekuatan ion-dipol dan gaya dipol-dipol adalah gaya antarmolekul yang ada antara berbagai spesies kimia seperti kation, anion, dan molekul kutub. Molekul polar adalah senyawa kovalen yang memiliki dipol (pemisahan muatan listrik). Molekul kutub memiliki terminal bermuatan positif dan terminal bermuatan negatif dalam molekul yang sama. Oleh karena itu, terminal ini dapat memiliki atraksi elektrostatik dengan muatan yang berlawanan. Perbedaan antara ion-dipol dan gaya dipol-dipol adalah bahwa gaya ion-dipol ada antara spesies ionik dan molekul polar sedangkan gaya dipol-dipol ada di antara molekul kutub.
Referensi:
1.“11.3: Pasukan dipol-dipol.”Kimia Libretexts, Libretexts, 11 Feb. 2018. Tersedia disini
2.Pasukan dipol-dipol. Tersedia disini
3.“Gaya antarmolekul.”Wikipedia, Wikimedia Foundation, 14 Mar. 2018. Tersedia disini
Gambar milik:
1.'Na+h2o'by taxman (domain publik) via commons wikimedia
2.'Dipole-Dipole-Interaction-in-HCl-2d'by Benjah-BMM27-Karya Sendiri, (Domain Publik) Via Commons Wikimedia


