Perbedaan antara isotonik dan isosmotik
Itu perbedaan utama Antara isotonik dan isosmotik adalah itu Larutan isotonik hanya mengandung zat terlarut yang tidak memantapkan sedangkan larutan isosmotik mengandung zat terlarut yang menembus maupun non-penetrasi. Perbedaan penting lainnya antara solusi isotonik dan isosmotik adalah bahwa solusi isotonik memiliki tekanan osmotik yang berbeda dari sel -sel yang dikelilingi sedangkan solusi isosmotik memiliki tekanan osmotik yang sama dengan sel -sel yang dikelilingi.
Isotonik dan isosmotik adalah jenis solusi dan istilah yang sering kita temui di laboratorium kimia. Banyak yang tetap bingung tentang perbedaan antara dua jenis solusi yang percaya bahwa mereka sama. Namun, mereka tidak sama dan kami akan menyoroti perbedaan mereka dalam artikel ini.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu zat terlarut
3. Apa isotonik
4. Apa itu isosmotik
5. Perbandingan berdampingan - isotonik vs isosmotik dalam bentuk tabel
6. Ringkasan
Apa itu zat terlarut?
Zat terlarut adalah zat yang larut dalam suatu larutan. Untuk memahami solusi isosmotik dan isotonik, kita harus menyadari bahwa mereka menembus zat terlarut atau zat terlarut non-penetrasi. Solut yang menembus adalah yang dapat melewati membran sel yang mempengaruhi tekanan osmotik melintasi membran. Di sisi lain, zat terlarut non-penetrasi tidak dapat melewati membran itulah sebabnya mereka hanya mempengaruhi tonikitas.
Apa isotonik?
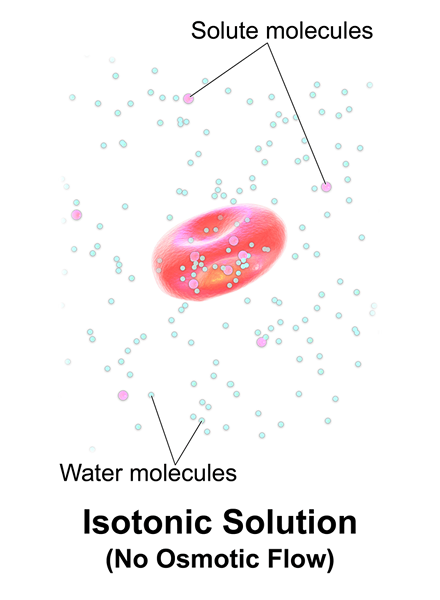
Isotonik adalah saat larutan memiliki konsentrasi garam yang sama dengan darah dan sel -sel tubuh manusia. Solusi isotonik hanya mengandung zat terlarut yang tidak memetrasi dan mengacu pada solusi yang memiliki tekanan osmotik yang sama dengan sel-sel yang dikelilingi.

Gambar 01: Solusi isotonik
Selain itu, mereka tidak menyerap apa pun dari sel dan sebaliknya (sel juga tidak menyerap zat terlarut dari solusi ini). Misalnya, solusi yang 154 mmnacl adalah isotonik untuk manusia.
Apa itu isosmotik?
Isosmotik adalah ketika dua solusi memiliki jumlah zat terlarut yang sama. Dengan demikian terlepas dari kenyataan bahwa mereka memiliki tekanan osmotik yang sama dengan sel, mereka mengelilingi. Mereka mengandung zat terlarut yang dapat masuk dan meningkatkan tekanan osmotik sel. Ketika tekanan osmotik sel meningkat menyebabkan sel menyerap air dari medium, ia mencapai keseimbangan dan tekanan osmotik sama dengan di kedua sisi. Ini mungkin memiliki efek pada sel sehingga akhirnya pecah.
Misalnya, sukrosa adalah solusi yang tidak memiliki ion. Larutan sukrosa yaitu 320 mm adalah isosmotik untuk manusia. Membandingkan larutan sukrosa ini dengan larutan NaCl 154mm, mengungkapkan bahwa itu adalah 154 mmsodium (NA) dan 154 mmchloride (cl) atau sekitar 308 miliosmolar yang mendekati 320 miliosmolar untuk sukrosa.
Apa perbedaan antara isotonik dan isosmotik?
Isotonik mengacu pada larutan yang memiliki konsentrasi zat terlarut yang sama seperti pada sel atau cairan tubuh. Isosmotik mengacu pada situasi dua solusi yang memiliki tekanan osmotik yang sama. Oleh karena itu, solusi isotonik hanya mengandung zat terlarut yang tidak memin-atas sedangkan solusi isosmotik mengandung baik-baik maupun zat terlarut yang tidak memetrasi.
Dengan pertimbangan hubungan yang dimiliki kedua jenis solusi ini dengan tekanan osmotik, solusi isotonik memiliki tekanan osmotik yang berbeda dari sel yang mereka kelilingi. Sebaliknya, larutan isosmotik memiliki tekanan osmotik yang sama dengan sel -sel yang mereka kelilingi. Selain itu, solusi isotonik tidak menyebabkan sel menyerap air dari sekitarnya atau kehilangan air dari sel. Namun, larutan isosmotik menyebabkan sel menyerap air dari sekitarnya atau kehilangan air dari sel.
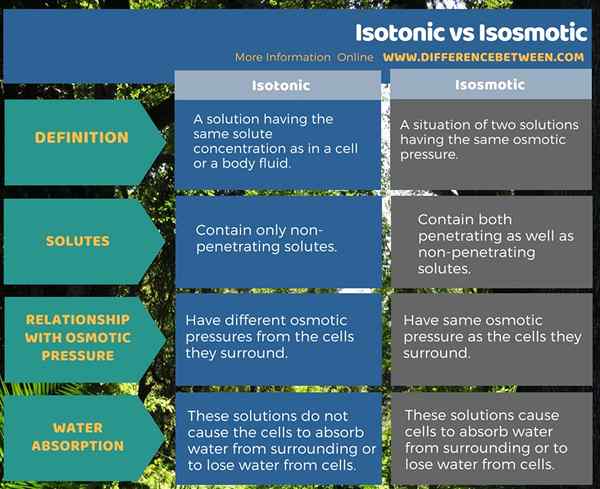
Ringkasan -isotonik vs isosmotik
Istilah isotonik dan isosmotik berguna dalam menggambarkan sifat cairan tubuh. Kedua istilah, isotonik mengungkapkan gagasan memiliki konsentrasi zat terlarut yang sama sementara istilah isosmotik mengungkapkan gagasan memiliki tekanan osmotik yang sama. Perbedaan antara isotonik dan isosmotik adalah bahwa larutan isotonik hanya mengandung zat terlarut non-penetrasi sedangkan larutan isosmotik mengandung penetrasi maupun zat terlarut non-penetrasi.
Referensi:
1. “Tonisitas.”Wikipedia, Wikimedia Foundation, 8 Feb. 2018. Tersedia disini
2. “Isosmotik.“Biologi Online. Tersedia disini
Gambar milik:
1.'Blausen 0685 osmoticflow isotonic'by blausen.Com Staff (2014). “Galeri Medis Blausen Medical 2014”. Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.010. ISSN 2002-4436. - Pekerjaan sendiri, (CC oleh 3.0) Via Commons Wikimedia


