Perbedaan antara kelarutan molar dan konstanta kelarutan produk

Itu perbedaan utama antara kelarutan molar dan konstanta kelarutan produk adalah bahwa Kelarutan molar menggambarkan pembubaran zat per liter suatu larutan, sedangkan konstanta kelarutan produk menggambarkan pembubaran zat padat dalam larutan berair.
Kelarutan molar dan konstanta kelarutan produk adalah konsep kimia yang menggambarkan pembubaran zat dalam solusi. Kita dapat menghitung kelarutan molar dari konstanta kelarutan produk. Oleh karena itu, mereka terkait satu sama lain.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu kelarutan molar
3. Apa itu konstanta kelarutan produk
4. Perbandingan berdampingan - Kelarutan molar dan konstanta kelarutan produk dalam bentuk tabel
5. Ringkasan
Apa itu kelarutan molar?
Kelarutan molar adalah jumlah mol zat yang larut per liter suatu larutan sebelum saturasi. Itu berarti; Kelarutan molar memberikan jumlah zat yang dapat kita larut dalam larutan sebelum larutan menjadi jenuh dari zat tertentu. Kami dapat menghitung jumlah ini menggunakan konstanta kelarutan produk atau KSP dan stoikiometri. Unit untuk kelarutan molar adalah mol/L. Kita dapat menunjukkan istilah ini sebagai "m". Kita dapat menghitung kelarutan molar menggunakan KSP, tetapi kita harus tahu ion yang dihasilkan oleh disosiasi selama pembubaran zat dalam larutan.

Mari kita pertimbangkan contoh; Jika AB dilarutkan dalam larutan berair, ia terpisah menjadi produk ionik A dan B. Persamaan untuk pembubaran ini adalah sebagai berikut:
AB(S) ⇌ a(aq) + B(aq)
Menurut stoikiometri reaksi ini, jika konsentrasi akhir A adalah "X", maka konsentrasi akhir B juga "x". Kemudian, persamaan produk kelarutan untuk reaksi ini adalah;
Ksp = [a] [b]
= [x] [x]
= x2
Di sini, x adalah kelarutan molar. Oleh karena itu, jika kita mengetahui KSP dari reaksi, kita dapat menghitung X, kelarutan molar dari reaksi.
Apa itu konstanta kelarutan produk?
Konstanta konstanta atau kelarutan produk konstanta produk adalah konstanta kesetimbangan untuk pembubaran zat padat dalam larutan berair. Oleh karena itu, ini menggambarkan pembubaran zat padat dalam larutan berair, dan itu mewakili tingkat di mana zat terlarut larut dalam larutan. Kami dapat menunjukkannya sebagai KSP. Secara umum, KSP dihitung dengan mengalikan konsentrasi produk ionik setelah pembubaran zat. Untuk pembubaran ab2, Reaksinya adalah sebagai berikut:
AB2 (s) ⇌ a(aq) + 2b(aq)
Untuk reaksi di atas, konstanta kelarutan produk atau KSP adalah sebagai berikut:
Ksp = [a(aq)][B(aq)]2
Apa perbedaan antara kelarutan molar dan konstanta kelarutan produk?
Keduanya, kelarutan molar dan konstanta kelarutan produk, menggambarkan pembubaran suatu zat dalam suatu larutan. Namun, perbedaan utama antara kelarutan molar dan konstanta kelarutan produk adalah bahwa kelarutan molar menggambarkan pembubaran zat per liter suatu larutan, sedangkan konstanta kelarutan produk menggambarkan pembubaran zat padat dalam larutan berair yang berair.
Selain itu, kelarutan molar adalah jumlah mol zat yang larut per liter suatu larutan sebelum saturasi. Sementara itu, konstanta kelarutan produk adalah, atau konstanta produk kelarutan adalah konstanta kesetimbangan untuk pembubaran zat padat dalam larutan berair. Kami dapat menunjukkan kelarutan molar sebagai "m" dan konstanta kelarutan produk sebagai "ksp".
Di bawah infografis merangkum perbedaan antara kelarutan molar dan konstanta kelarutan produk.
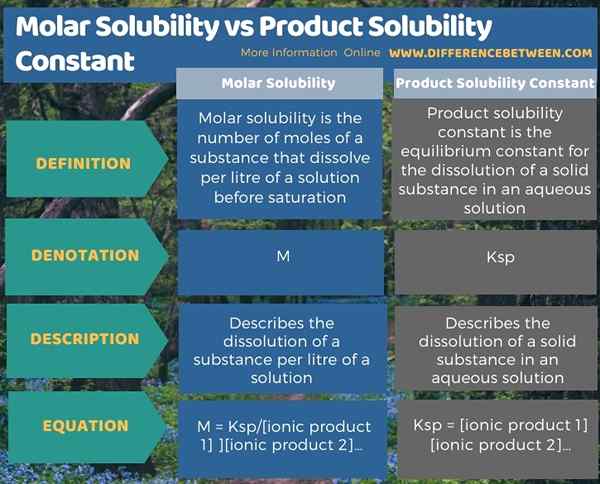
Ringkasan -Kelarutan Molar vs Konstanta Kelarutan Produk
Singkatnya, keduanya, kelarutan molar dan konstanta kelarutan produk, menggambarkan pembubaran suatu zat dalam suatu larutan. Namun, perbedaan utama antara kelarutan molar dan konstanta kelarutan produk adalah bahwa kelarutan molar menggambarkan pembubaran zat per liter suatu larutan, sedangkan konstanta kelarutan produk menggambarkan pembubaran zat padat dalam larutan berair yang berair.
Referensi:
1. “Konstanta produk kelarutan, KSP.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
2. “Kelarutan molar.”Wikipedia, Wikimedia Foundation, 5 Apr. 2019, tersedia di sini.
3. “Keseimbangan kelarutan.”Wikipedia, Wikimedia Foundation, 26 September. 2019, tersedia di sini.


