Perbedaan antara isomerisme posisi dan metamerisme
Perbedaan Utama - Posisi Isomerisme vs Metamerisme
Isomerisme dapat didefinisikan sebagai keberadaan senyawa kimia yang memiliki formula struktural yang sama tetapi pengaturan spasial yang berbeda. Ini berarti, isomer memiliki jumlah atom yang sama di setiap elemen, tetapi pengaturannya berbeda. Isomer terutama dikategorikan ke dalam dua kelompok bernama isomer struktural dan stereoisomer. Isomer struktural sekali lagi dibagi menjadi tiga kelompok sebagai isomer rantai, isomer posisi, dan isomer kelompok fungsional. Metamers juga merupakan jenis isomer struktural, tetapi mereka tidak ditemukan secara umum. Perbedaan utama antara isomerisme posisi dan metamerisme adalah bahwa, Dalam posisi isomerisme, kelompok fungsional melekat pada posisi yang berbeda sedangkan, dalam metamerisme, kelompok alkil yang berbeda melekat pada kelompok fungsional yang sama.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu posisi isomerisme
3. Apa itu metamerisme
4. Perbandingan Berdampingan - Posisi Isomerisme vs Metamerisme
5. Ringkasan
Apa itu posisi isomerisme?
Posisi isomerisme dapat didefinisikan sebagai "gerakan" kelompok fungsional dalam molekul. Ini berarti, hanya posisi kelompok fungsional yang diubah dalam jenis isomerisme ini. Jumlah atom karbon, formula molekul, struktur tulang punggung karbon, dan jumlah kelompok fungsional sama untuk isomer dalam isomerisme posisi. Tetapi jenis isomerisme ini tidak ada dalam senyawa yang memiliki gugus akhir seperti asam karboksilat, aldehida, dll. Karena kelompok -kelompok ini tidak dapat diposisikan di tengah rantai karbon.
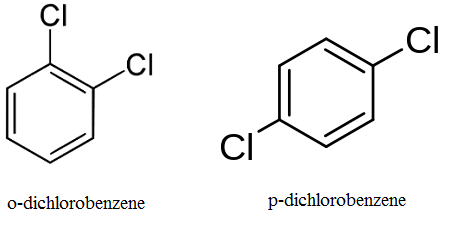
Misalnya, propil bromida dan isopropil bromida adalah isomer posisi. Dalam propyl bromide, gugus fungsional adalah -br dan melekat pada ujung rantai karbon sedangkan dalam isopropil bromida, -br kelompok melekat pada atom karbon tengah dari rantai karbon.

Gambar 01: Posisi isomerisme dalam O-Dichlorobenzene dan P-Dichlorobenzene
Apa itu metamerisme?
Dalam kasus metamerisme, jenis -jenis kelompok alkil di sisi kelompok fungsional akan berbeda satu sama lain. Ini adalah distribusi atom karbon yang tidak setara. Metamerisme termasuk dalam seri homolog yang sama, yang berarti, bahwa jumlah atom karbon dapat meningkat secara bertahap untuk mendapatkan isomer yang berbeda. Oleh karena itu, struktur hanya berbeda dengan jumlah ch2 Kelompok dalam rantai karbon utama.
Gugus alkil selalu melekat pada sisi atom divalen seperti oksigen atau sulfida, atau gugus alkil dapat melekat pada kelompok divalen seperti -nh-. Metamerisme jarang ditemukan karena keterbatasan ini. Oleh karena itu, sebagian besar senyawa yang ditemukan dalam metamerisme adalah eter dan amina.
Misalnya, dietil eter dan metil propil eter adalah metamer. Di sini, kelompok fungsionalnya adalah eter dan atom divalen adalah atom oksigen. Dietil eter memiliki dua gugus etil sedangkan metil propil eter memiliki metil dan gugus propil di sisi atom oksigen.
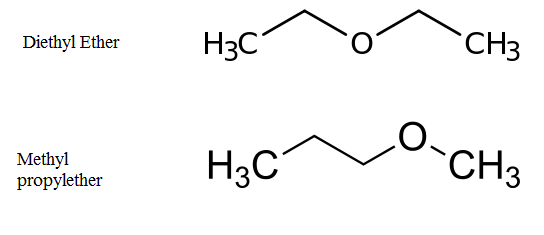
Gambar 02: Metamerisme dalam metil propil eter dan dietil eter
Apa perbedaan antara isomerisme posisi dan metamerisme?
Posisi isomerisme vs metamerisme | |
| Dalam posisi isomerisme, posisi kelompok fungsional berbeda. | Dalam metamerisme, jenis kelompok alkil yang melekat pada kelompok fungsional berbeda. |
| Jumlah isomer | |
| Posisi isomerisme menunjukkan sejumlah isomer yang hanya berbeda dengan posisi kelompok fungsional | Metamerisme memiliki sejumlah isomer karena keterbatasannya seperti kelompok alkil yang hanya dilampirkan pada atom atau kelompok divalen. |
| Kelompok fungsional spesifik | |
| Posisi isomerisme tidak dapat dilihat pada senyawa yang hanya memiliki aldehida, karboksilat seperti kelompok akhir. | Metamerisme hanya dapat dilihat pada eter atau senyawa lain yang mengandung atom divalen. |
| Kelompok alkil | |
| Kelompok alkil yang sama melekat pada kelompok fungsional dalam isomer isomerisme posisi. | Kelompok alkil yang berbeda melekat pada kelompok fungsional dalam metamerisme. |
| Seri | |
| Ini milik serial non-homolog. | Ini milik seri homolog |
Ringkasan - Posisi Isomerisme vs Metamerisme
Perbedaan utama antara isomerisme posisi dan metamerisme adalah bahwa, dalam posisi isomerisme, lokasi kelompok fungsional diubah sedangkan, dalam metamerisme, jenis kelompok alkil di sisi kelompok fungsional diubah.
Referensi:
1. Carey, f. A. & Sundberg, R. J., 2007. Kimia Organik Lanjutan. Edisi ke -5. Charlottesville: Springer.
2. “Prinsip dasar dalam kimia organik: isomerisme struktural.Proyek Pengajaran Terbuka. N.P., N.D. Web. 25 Mei 2017.
3. Vardhan, v. Aditya. “Isomerisme dalam senyawa organik.”Aidchemistry. N.P., N.D. Web. 25 Mei 2017. .
Gambar milik:
1. "1,2 -diklorobenzene" oleh pengunggah asli adalah Sbrools di Wikipedia Inggris - (domain publik) melalui Commons Wikimeida
2. Domain Publik "O-Dichlorobenzene") melalui Commons Wikimedia
3. "Diethylether" oleh Gaussianer - karya sendiri, domain publik) melalui Commons Wikimedia
4. “1 -Methoxypropane 200” oleh Emeldir (Talk) - Pekerjaan Sendiri (Domain Publik) melalui Commons Wikimedia


