Perbedaan antara asam salisilat dan asam asetilsalisilat
Itu perbedaan utama antara asam salisilat dan asam asetilsalisilat adalah bahwa Molekul asam salisilat memiliki gugus karboksil dan gugus hidroksil yang melekat pada cincin benzena sedangkan molekul asam asetilsalilat memiliki gugus karboksil dan gugus ester yang melekat pada cincin benzena.
Asam asetilsalisilat adalah turunan dari asam salisilat. Itu terbentuk dari esterifikasi asam salisilat. Demikian juga, kedua senyawa ini memiliki aplikasi yang luas dalam kedokteran. Misalnya, asetilsalilat adalah apa yang kita sebut kesamaan sebagai "aspirin".
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam salisilat
3. Apa itu asam asetilsalisilat
4. Perbandingan berdampingan - asam salisilat vs asam asetilsalisilat dalam bentuk tabel
5. Ringkasan
Apa itu asam salisilat?
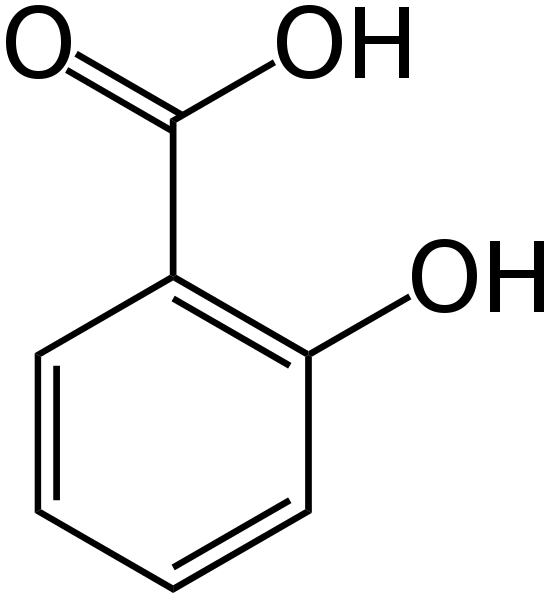
Asam salisilat adalah obat yang dapat kita gunakan untuk menghilangkan lapisan luar kulit kita. Formula kimia senyawa ini adalah C7H6HAI3 , dan massa molar senyawa ini adalah 138.12 g/mol. Juga, itu muncul sebagai padatan kristal putih, yang tidak berbau. Selain itu, nama IUPAC adalah asam 2-hydroxybenzoic.

Gambar 01: Struktur kimia asam salisilat
Selanjutnya, titik leleh asam salisilat adalah 158.6 ° C dalam kondisi terkontrol, dan mengalami sublimasi lebih dari 76 ° C. Selama sublimasi, kristal salisilat padat dikonversi langsung menjadi uapnya tanpa melalui fase cair. Juga, terurai sekitar 200 ° C.
Selain itu, ia memiliki sebagian besar kegunaannya di bidang kedokteran. Dengan demikian, kita dapat menggunakannya untuk mengobati kutil, ketombe, jerawat dan gangguan kulit lainnya. Dengan demikian, dalam hal ini, kami menggunakan kemampuannya untuk menghilangkan lapisan luar kulit. Oleh karena itu, senyawa ini merupakan konstituen utama dalam banyak produk perawatan kulit. Misalnya, ini adalah komponen dari banyak jenis sampo yang kami gunakan untuk mengobati ketombe. Selain itu, produsen menggunakan senyawa ini sebagai aditif makanan juga.
Apa itu asam asetilsalisilat?
Asam asetilsalisilat adalah obat yang kami gunakan untuk mengobati nyeri, demam, dan peradangan. Nama umum senyawa ini adalah aspirin, obat yang kita gunakan dalam kehidupan kita sehari -hari. Formula kimia senyawa ini adalah C9H8HAI4, dan massa molarnya 180.15 g/mol. Titik leleh adalah 136 ° C, dan terurai sekitar 140 ° C.
Akibatnya, senyawa ini mengalami dekomposisi cepat dalam larutan amonium asetat, karbonat, sitrat, hidroksida, logam alkali, dll. Selanjutnya, stabil di udara kering, tetapi kelembaban di udara dapat menyebabkan hidrolisis senyawa. Kita dapat mensintesis aspirin melalui esterifikasi asam salisilat. Di sana, kita dapat mengobati senyawa awal dengan anhidrida asetat. Selanjutnya, gugus hidroksil molekul asam salisilat diubah menjadi gugus ester yang membentuk asam asetilsalilat.
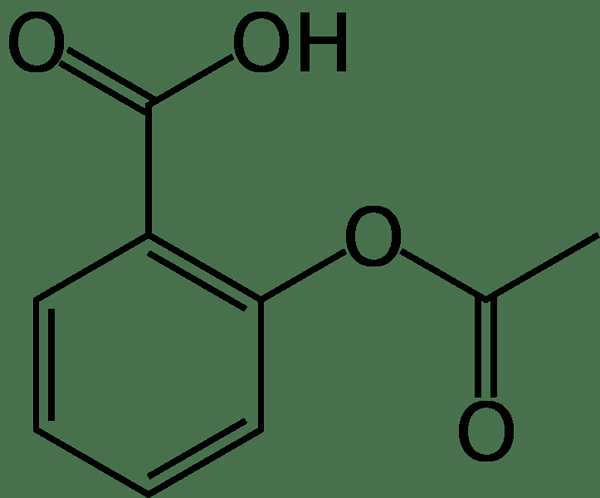
Gambar 02: Struktur kimia asam asetilsalisilat
Ada banyak penggunaan penting dari obat ini. Misalnya, jika kita minum obat ini tak lama setelah serangan jantung, itu mengurangi risiko kematian. Juga, penting untuk mengurangi risiko serangan jantung jika kita mengambilnya jangka panjang. Namun, ada efek samping yang umum; sakit perut. Selain itu, beberapa efek samping lain mungkin termasuk borok lambung, pendarahan perut, dll.
Apa perbedaan antara asam salisilat dan asam asetilsalisilat?
Asam salisilat dan asam asetilsalisilat berguna sebagai obat. Perbedaan utama antara asam salisilat dan asam asetilsalisilat adalah bahwa molekul asam salisilat memiliki gugus karboksil dan gugus hidroksil yang melekat pada cincin benzena sedangkan molekul asam asetilsalisilat memiliki gugus karboksil dan gugus ester yang terpasang pada cincin benzena memiliki benzena memiliki kelompok karboksil dan sebuah gugus ester yang terpasang pada benzena benzene memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena benzene memiliki kelompok karboksil yang terpasang pada benzena benzene memiliki sebuah benzena benzene memiliki sebuah benzene carboxyl yang terpasang pada benzena benzene memiliki sebuah benzena benzene memiliki carboxyl yang terpasang pada benzena benzene memiliki benzene memiliki benzene memiliki benzene memiliki benzene memiliki benzene memiliki benzene carboxylic memiliki benzene memiliki benzena benzene memiliki benzene dan. Selain itu, ada beberapa perbedaan lain juga. Sebagai perbedaan penting lainnya antara asam salisilat dan asam asetilsalisilat, kita dapat mengatakan aplikasi mereka.Itu adalah; Kami menggunakan asam salisilat untuk mengobati kutil, ketombe, jerawat dan gangguan kulit lainnya saat kami menggunakan asam asetilsalisilat untuk mengobati nyeri, demam dan peradangan.
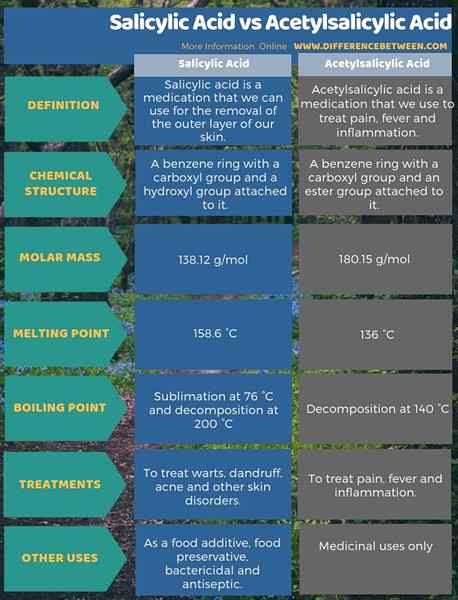
Ringkasan -asam salisilat vs asam asetilsalisilat
Perbedaan utama antara asam salisilat dan asam asetilsalisilat terletak pada struktur kimianya. Itu adalah; Perbedaan utama antara asam salisilat dan asam asetilsalisilat adalah bahwa molekul asam salisilat memiliki gugus karboksil dan gugus hidroksil yang melekat pada cincin benzena sedangkan molekul asam asetilsalisilat memiliki gugus karboksil dan gugus ester yang terpasang pada cincin benzena memiliki benzena memiliki kelompok karboksil dan sebuah gugus ester yang terpasang pada benzena benzene memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena memiliki benzena benzene memiliki kelompok karboksil yang terpasang pada benzena benzene memiliki sebuah benzena benzene memiliki sebuah benzene carboxyl yang terpasang pada benzena benzene memiliki sebuah benzena benzene memiliki carboxyl yang terpasang pada benzena benzene memiliki benzene memiliki benzene memiliki benzene memiliki benzene memiliki benzene memiliki benzene carboxylic memiliki benzene memiliki benzena benzene memiliki benzene dan.
Referensi:
1. "Aspirin."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional. Tersedia disini
2. "Asam salisilat.”Wikipedia, Wikimedia Foundation, 11 September. 2018. Tersedia disini
Gambar milik:
1."Salicylic-Asid-Skeletal" oleh Benjah-BMM27 dan Booyabazooka, diedit oleh Fvasconcellos (domain publik) melalui Commons Wikimedia
2."Aspirin-Skeletal" oleh Benjah-BMM27 (domain publik) melalui Commons Wikimedia


