Perbedaan antara isotop dan elemen
Itu perbedaan utama antara isotop dan elemen adalah bahwa Isotop adalah bentuk yang berbeda dari unsur kimia yang sama sedangkan unsur -unsurnya adalah spesies atom yang memiliki jumlah proton yang sama dalam inti atom.
Jenis atom yang serupa dapat mengalami sedikit perubahan untuk membentuk isotop yang berbeda. Elemen mungkin memiliki beberapa isotop. Sifat masing -masing isotop berkontribusi pada sifat elemen. Di sini, kita akan membahas secara rinci tentang isotop dan elemen untuk menjelaskan perbedaan antara isotop dan elemen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu isotop
3. Apa itu elemen
4. Perbandingan berdampingan - isotop vs elemen dalam bentuk tabel
5. Ringkasan
Apa itu isotop?
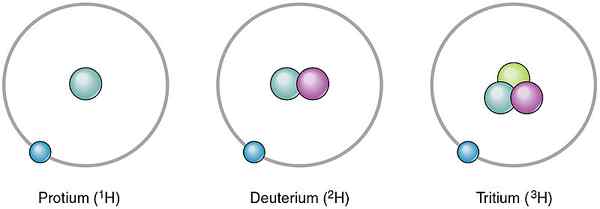
Atom dari elemen yang sama bisa berbeda satu sama lain. Atom yang berbeda dari elemen yang sama ini adalah isotop. Mereka berbeda satu sama lain dengan memiliki jumlah neutron yang berbeda. Karena nomor neutron berbeda, jumlah massa mereka juga berbeda. Namun, isotop dari elemen yang sama memiliki jumlah proton yang sama. Di alam, isotop yang berbeda terjadi dalam berbagai jumlah. Oleh karena itu, kita dapat memberikan kejadian mereka sebagai nilai persentase yang disebut kelimpahan relatif. Misalnya, hidrogen memiliki tiga isotop seperti protium, deuterium dan tritium. Jumlah proton dalam inti atomnya adalah sama, tetapi jumlah neutron berbeda. Neutron dan kelimpahan relatif mereka adalah sebagai berikut.
- 1H - Tidak ada neutron, kelimpahan relatif 99.985%
- 2H- satu neutron, kelimpahan relatif adalah 0.015%
- 3H- Dua neutron, kelimpahan relatif adalah 0%

Gambar 01: Isotop hidrogen
Jumlah neutron yang dapat ditahan oleh nukleus berbeda dari elemen ke elemen. Di antara isotop ini, hanya beberapa yang stabil. Misalnya, oksigen memiliki tiga isotop stabil, dan timah memiliki sepuluh isotop stabil. Sebagian besar waktu, elemen sederhana memiliki nomor neutron yang sama dengan nomor proton. Tetapi dalam elemen berat, lebih banyak neutron ada daripada jumlah proton.
Selanjutnya, jumlah neutron penting untuk menyeimbangkan stabilitas inti. Ketika inti terlalu berat, mereka menjadi tidak stabil dan karenanya, isotop itu menjadi radioaktif. Misalnya, 238U memancarkan radiasi dan meluruh menjadi inti yang jauh lebih kecil. Isotop mungkin memiliki sifat yang berbeda karena massa yang berbeda. Misalnya, mereka dapat memiliki putaran yang berbeda. Dengan demikian, spektrum NMR mereka berbeda. Namun, jumlah elektron mereka serupa sehingga menimbulkan perilaku kimia yang serupa.
Apa itu elemen?
Kami akrab dengan kata "elemen," karena kami belajar tentang mereka di tabel periodik. Ada sekitar 118 elemen kimia dalam tabel periodik, dan mereka diatur sesuai dengan nomor atomnya. Elemen adalah spesies kimia, yang hanya mewakili satu jenis atom. Karenanya, mereka murni. Selanjutnya, atom dari elemen yang sama memiliki jumlah proton yang sama dalam inti atomnya. Tapi, jumlah neutron dapat berbeda satu sama lain. Misalnya, elemen terkecil adalah hidrogen. Perak, emas, platinum adalah beberapa elemen berharga yang umum diketahui.
Setiap elemen memiliki massa atom, nomor atom, simbol, konfigurasi elektronik, dll. Meskipun sebagian besar elemen secara alami terjadi, ada beberapa elemen sintetis seperti Californium, Americium, Einsteinium, dan Mendelevium. Kami dapat mengkategorikan semua elemen menjadi tiga kelompok; sebagai logam, metaloid, dan bukan logam.
Gambar 02: Endoskeleton
Selanjutnya, kami dapat mengkategorikannya ke dalam kelompok dan periode berdasarkan karakteristik yang lebih spesifik. Juga, elemen dalam kelompok atau periode yang sama berbagi karakteristik umum tertentu, dan beberapa properti dapat berubah secara berurutan saat Anda melalui grup atau periode. Selain itu, elemen dapat mengalami perubahan kimia untuk membentuk berbagai senyawa; Namun, kami tidak dapat memecah elemen lebih lanjut dengan metode kimia sederhana.
Apa perbedaan antara isotop dan elemen?
Istilah elemen kimia menggambarkan spesies atom sementara istilah isotop menggambarkan berbagai bentuk elemen kimia yang sama. Oleh karena itu, perbedaan utama antara isotop dan elemen adalah bahwa isotop adalah bentuk yang berbeda dari unsur kimia yang sama sedangkan unsur -unsur adalah spesies atom yang memiliki jumlah proton yang sama dalam inti atomik. Selain itu, satu perbedaan lain antara isotop dan elemen adalah bahwa isotop memiliki jumlah neutron yang berbeda, tetapi elemen kimia dapat memiliki jumlah neutron yang sama atau jumlah neutron yang berbeda; tetapi mereka tidak pernah memiliki jumlah proton yang sama.
Sebagai perbedaan penting lainnya antara isotop dan elemen, kita dapat mengatakan bahwa massa atom isotop dapat dihitung dengan hanya menambahkan massa total proton dan neutron dalam inti atom sedangkan kita dapat menghitung massa atom dari unsur kimia menggunakan atomik massa isotopnya dan kelimpahan relatifnya.

Ringkasan -Isotop vs Elemen
Isotop adalah bentuk atom yang berbeda dari elemen kimia yang sama. Perbedaan utama antara isotop dan elemen adalah bahwa isotop adalah bentuk yang berbeda dari unsur kimia yang sama sedangkan unsur -unsurnya adalah spesies atom yang memiliki jumlah proton yang sama dalam inti atomik.
Referensi:
1. “Elemen Kimia.”Wikipedia, Wikimedia Foundation, 11 Nov. 2018. Tersedia disini
2. Helmenstine, Anne Marie, PH.D. “Definisi dan contoh isotop dalam kimia."Thoughtco, OCT. 22, 2018. Tersedia disini
Gambar milik:
1.”204 Isotop Hydrogen -01" oleh OpenStax College - Anatomi & Fisiologi, Situs Web Connexions. (CC oleh 3.0) Via Commons Wikimedia
2.”Sederhana Tabel Periodik -en” oleh Offnfopt - karya sendiri, (domain publik) via Commons Wikimedia


