Perbedaan antara energi solvasi dan energi kisi
Perbedaan Utama - Energi Solvasi vs Energi kisi
Energi solvasi adalah perubahan energi Gibbs dari pelarut ketika zat terlarut dibubarkan dalam pelarut itu. Energi kisi adalah jumlah energi yang dilepaskan selama pembentukan kisi dari ion atau jumlah energi yang dibutuhkan untuk memecah kisi. Itu perbedaan utama antara energi solvasi dan energi kisi adalah itu Energi pelarut memberikan perubahan entalpi saat melarutkan zat terlarut dalam pelarut sedangkan energi kisi memberikan perubahan entalpi saat pembentukan (atau kerusakan) kisi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu energi solvasi
3. Apa itu energi kisi
4. Perbandingan Berdampingan - Energi Solvasi vs Energi Kisi Dalam Bentuk Tabel
5. Ringkasan
Apa itu energi solvasi?
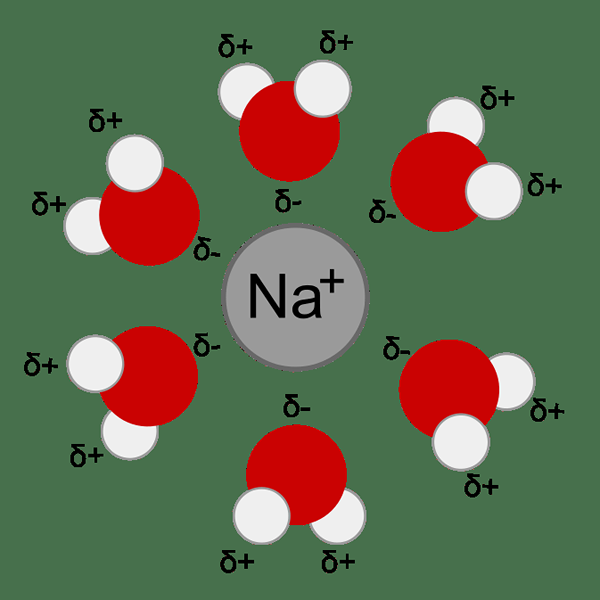
Energi solvasi adalah perubahan energi Gibbs ketika ion atau molekul ditransfer dari vakum (atau fase gas) ke pelarut. Solvasi adalah interaksi antara pelarut dan molekul atau ion dari zat terlarut. Zat terlarut adalah senyawa yang akan dilarutkan dalam pelarut. Beberapa zat terlarut terdiri dari molekul sedangkan beberapa mengandung ion.
Interaksi antara partikel pelarut dan zat terlarut menentukan banyak sifat zat terlarut. Contoh: Kelarutan, reaktivitas, warna, dll. Selama proses solvasi, partikel terlarut dikelilingi oleh molekul pelarut yang membentuk kompleks solvasi. Ketika pelarut yang terlibat dalam pelarut ini adalah air, prosesnya disebut hidrasi.
Berbagai jenis ikatan kimia dan interaksi terbentuk selama proses solvasi; Ikatan hidrogen, interaksi ion-dipol dan gaya van der Waal. Sifat pelarut komplementer dan zat terlarut menentukan kelarutan zat terlarut dalam pelarut. Misalnya, polaritas adalah faktor utama yang menentukan kelarutan zat terlarut dalam pelarut. Zat terlarut kutub larut dengan baik dalam pelarut kutub. Solut nonpolar larut dengan baik dalam pelarut nonpolar. Tetapi kelarutan zat terlarut dalam pelarut nonpolar (dan sebaliknya) buruk.

Gambar 01: Solvasi kation natrium dalam air
Ketika datang ke termodinamika, solvasinya dimungkinkan (spontan) hanya jika energi Gibbs dari solusi akhir lebih rendah dari energi Gibbs individu pelarut dan pelarut. Oleh karena itu, energi bebas Gibbs harus menjadi nilai negatif (energi bebas Gibbs dari sistem harus dikurangi setelah pembentukan solusi). Solvasi mencakup langkah yang berbeda dengan energi yang berbeda.
- Pembentukan rongga pelarut untuk membuat ruang untuk zat terlarut. Ini secara termodinamik tidak menguntungkan karena ketika interaksi antara molekul pelarut menurun, dan entropi berkurang.
- Pemisahan partikel zat terlarut dari curah juga secara termodinamik tidak menguntungkan. Itu karena interaksi terlarut-larut berkurang.
- Interaksi pelarut-larut terjadi ketika zat terlarut memasuki rongga pelarut sangat menguntungkan secara termodinamik.
Energi solvasi juga dikenal sebagai entalpi solvasi. Sangat berguna untuk menjelaskan pembubaran beberapa kisi dalam pelarut sementara beberapa kisi tidak. Perubahan entalpi larutan adalah perbedaan antara energi melepaskan zat terlarut dari curah dan menggabungkan zat terlarut dengan pelarut. Jika ion memiliki nilai negatif untuk perubahan entalpi dari larutan, itu menunjukkan bahwa ion lebih cenderung larut dalam pelarut itu. Nilai positif yang tinggi menunjukkan bahwa ion lebih kecil kemungkinannya untuk larut.
Apa itu energi kisi?
Energi kisi adalah ukuran energi yang terkandung dalam kisi kristal senyawa, sama dengan energi yang akan dilepaskan jika ion komponen disatukan dari tak terbatas. Energi kisi senyawa juga dapat didefinisikan sebagai jumlah energi yang dibutuhkan untuk memecah padatan ionik menjadi atom -atomnya dalam fase gas.
Padatan ionik adalah senyawa yang sangat stabil karena entalpi pembentukan molekul ionik bersama dengan stabilitas karena energi kisi dari struktur padat. Tetapi energi kisi tidak dapat diukur secara eksperimental. Oleh karena itu, a Siklus terlahir-haber digunakan untuk menentukan energi kisi dari padatan ionik. Ada beberapa istilah yang perlu dipahami sebelum menggambar siklus haber lahir.
- Energi ionisasi - Jumlah energi yang dibutuhkan untuk menghilangkan elektron dari atom netral dalam gas
- Afinitas elektron - jumlah energi yang dilepaskan ketika elektron ditambahkan ke atom netral dalam gas
- Energi Disosiasi - Jumlah energi yang dibutuhkan untuk memecah senyawa menjadi atom atau ion.
- Energi Sublimasi - Jumlah energi yang dibutuhkan untuk mengubah padatan menjadi uapnya
- Panas Formasi - Perubahan energi saat senyawa terbentuk dari unsur -unsurnya.
- Hukum Hess - Undang -undang yang menyatakan bahwa perubahan keseluruhan dalam energi dari proses tertentu dapat ditentukan dengan memecah proses menjadi langkah yang berbeda.
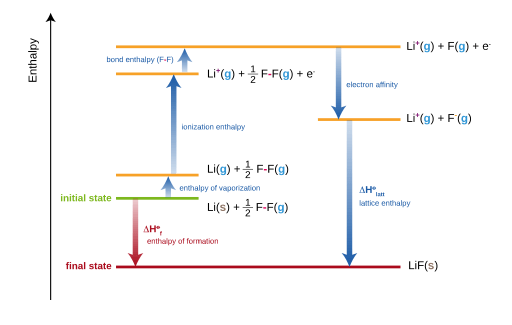
Gambar 02: Siklus Haber Terlahir untuk Pembentukan Lithium Fluoride (LIF)
Siklus haber yang dilahirkan dapat diberikan dengan persamaan berikut.
Panas formasi = panas atomisasi + energi disosiasi + jumlah energi ionisasi + jumlah afinitas elektron + energi kisi
Kemudian energi kisi suatu senyawa dapat diperoleh dengan mengatur ulang persamaan ini sebagai berikut.
Energi kisi = panas pembentukan - panas atomisasi + energi disosiasi + jumlah energi ionisasi + jumlah afinitas elektron
Apa perbedaan antara energi solvasi dan energi kisi?
Energi solvasi vs energi kisi | |
| Energi solvasi adalah perubahan energi Gibbs ketika ion atau molekul ditransfer dari vakum (atau fase gas) ke pelarut. | Energi kisi adalah ukuran energi yang terkandung dalam kisi kristal senyawa, sama dengan energi yang akan dilepaskan jika ion komponen disatukan dari tak terbatas. |
| Prinsip | |
| Energi pelarut memberikan perubahan entalpi saat melarutkan zat terlarut dalam pelarut. | Energi kisi memberikan perubahan entalpi saat pembentukan (atau kerusakan) kisi. |
Ringkasan - Energi solvasi vs Energi kisi
Energi solvasi adalah perubahan entalpi suatu sistem selama pelarut zat terlarut dalam pelarut. Energi kisi adalah jumlah energi yang dilepaskan selama pembentukan kisi atau jumlah energi yang dibutuhkan untuk memecah kisi. Perbedaan antara energi solvasi dan energi kisi adalah bahwa energi solvasi memberikan perubahan entalpi saat melarutkan zat terlarut dalam pelarut sedangkan energi kisi memberikan perubahan entalpi saat pembentukan (atau kerusakan) kisi -kisi.
Referensi:
1.“Energi kisi.”Chem.Purdue.edu. Tersedia disini
2.Persatuan Internasional Kimia Murni dan Terapan. “Energi solvasi.IUPAC Gold Book - Energi Solvasi. Tersedia disini
3.“Solvasi.”Wikipedia, Wikimedia Foundation, 5 Mar. 2018. Tersedia disini
Gambar milik:
1.'Na+h2o'by taxman (domain publik) via commons wikimedia
2.'Born-Haber Cycle Lif'by Jkwchui-karya sendiri, (CC BY-SA 3.0) Via Commons Wikimedia


