Perbedaan antara reaksi sintesis dan reaksi substitusi
Itu perbedaan utama Antara reaksi sintesis dan reaksi substitusi adalah bahwa Reaksi sintesis memberikan senyawa kimia baru yang terbentuk dari kombinasi reaktan, sedangkan reaksi substitusi memberikan senyawa kimia yang berasal dari senyawa kimia yang ada.
Reaksi sintesis dan reaksi substitusi adalah reaksi sintesis organik yang penting. Kedua reaksi ini membentuk senyawa kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu reaksi sintesis
3. Apa itu reaksi substitusi
4. Perbandingan berdampingan - Reaksi sintesis vs reaksi substitusi dalam bentuk tabel
5. Ringkasan
Apa itu reaksi sintesis?
Reaksi sintesis adalah jenis reaksi kimia di mana dua atau lebih komponen bergabung satu sama lain untuk membentuk senyawa besar. Reaksi sintesis adalah kebalikan dari reaksi disosiasi. Kita dapat menyebutnya reaksi kombinasi langsung juga karena melibatkan kombinasi komponen untuk membentuk senyawa baru. Selain itu, reaktan dalam reaksi ini adalah elemen kimia atau molekul. Produk akhir dari reaksi sintesis selalu merupakan senyawa atau kompleks.
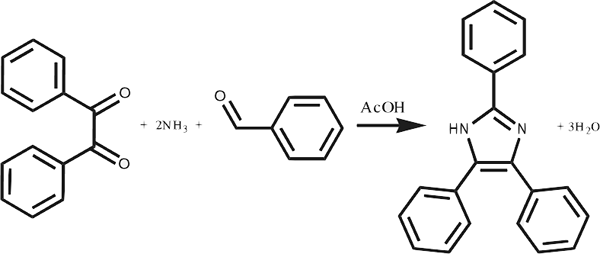
Sebagai contoh, kombinasi gas hidrogen dan gas oksigen yang membentuk molekul air, kombinasi karbon monoksida dan oksigen yang membentuk karbon dioksida, kombinasi logam aluminium dan gas oksigen yang membentuk aluminium oksida, dll.

Gambar 01: Pembentukan senyawa kimia besar melalui kombinasi molekul reaktan kecil
Kita dapat mengenali reaksi sintesis melalui mengamati produk akhir; Itu selalu merupakan senyawa. Dalam reaksi ini, semua atom yang ada dalam molekul reaktan harus ada di produk akhir. Selain itu, selama pembentukan ikatan, reaksi ini melepaskan energi; Oleh karena itu, mereka adalah reaksi eksotermik.
Apa itu reaksi substitusi?
Reaksi substitusi adalah reaksi kimia di mana gugus molekul menggantikan gugus molekul lain. Bagian adalah bagian dari molekul. Dalam reaksi ini, gugus adalah atom, ion, atau kelompok fungsional. Selanjutnya, reaksi ini sebagian besar terjadi dengan mengganti kelompok fungsional molekul dengan kelompok fungsional lain. Reaksi kimia ini adalah reaksi yang sangat penting dalam kimia organik.
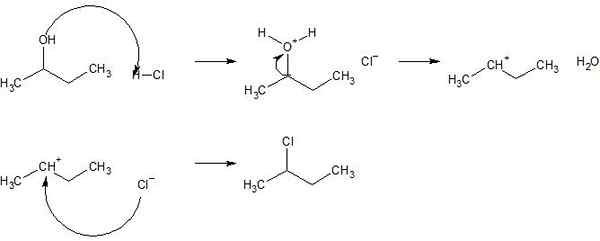
Gambar 02: Mekanisme Reaksi Substitusi untuk 2-Chlorobutane
Selain itu, ada dua jenis reaksi substitusi sebagai reaksi substitusi elektrofilik dan reaksi substitusi nukleofilik. Namun, ada kategori lain juga; Itulah reaksi substitusi radikal.
Apa perbedaan antara reaksi sintesis dan reaksi substitusi?
Reaksi sintesis dan reaksi substitusi adalah reaksi kimia penting dalam kimia organik. Perbedaan utama antara reaksi sintesis dan reaksi substitusi adalah bahwa reaksi sintesis memberikan senyawa kimia baru yang terbentuk dari kombinasi reaktan, sedangkan reaksi substitusi memberikan senyawa kimia yang berasal dari senyawa kimia yang ada. Contoh reaksi sintesis adalah kombinasi gas hidrogen dan gas oksigen untuk membentuk molekul air sementara contoh untuk reaksi substitusi adalah reaksi gardu elektrofilik dari 2-klorobutane.
Infografis berikut menunjukkan lebih banyak perbandingan antara kedua reaksi untuk membedakan perbedaan antara reaksi sintesis dan reaksi substitusi.
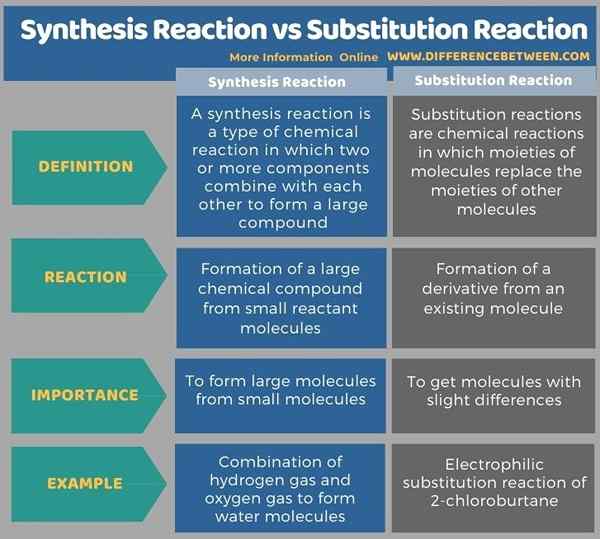
Ringkasan -Reaksi Sintesis vs Reaksi Substitusi
Reaksi sintesis dan reaksi substitusi adalah reaksi kimia penting dalam kimia organik. Singkatnya, perbedaan utama antara reaksi sintesis dan reaksi substitusi adalah bahwa reaksi sintesis memberikan senyawa kimia baru yang terbentuk dari kombinasi reaktan, sedangkan reaksi substitusi memberikan senyawa kimia yang berasal dari senyawa kimia yang ada.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Reaksi Substitusi."Thoughtco, Feb. 11, 2020, tersedia di sini.
2. Helmenstine, Anne Marie. “Deskripsi Reaksi Sintesis Ditambah Contoh."Thoughtco, Feb. 11, 2020, tersedia di sini.
Gambar milik:
1. “Reaksi Lofin-Sintesis” oleh Adam001D di Polandia Wikipedia (CC oleh 3.0) Via Commons Wikimedia
2. “2 Mekanisme Substitusi Chlorobutane” oleh Ajoyce7 - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


