Apa perbedaan antara sulfit dan sulfur trioksida
Itu Perbedaan utama antara sulfit dan sulfur trioksida adalah bahwa sulfit adalah senyawa ionik yang memiliki anion sulfat (IV) sedangkan sulfur trioksida adalah senyawa non-ionik.
Sulfit dan sulfur trioksida adalah senyawa kimia yang mengandung atom belerang. Istilah sulfit mengacu pada senyawa ionik yang mengandung anion sulfit yang terikat pada kation yang berbeda. Sulfur trioksida adalah senyawa anorganik yang memiliki formula kimia SO3.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu sulfit
3. Apa itu sulfur trioksida
4. Sulfit vs sulfur trioksida dalam bentuk tabel
5. Ringkasan -sulfit vs sulfur trioksida
Apa itu sulfit?
Istilah sulfit mengacu pada senyawa ionik yang mengandung anion sulfit yang terikat pada kation yang berbeda. Formula kimia untuk anion sulfit demikian32-. Itu juga dinamai sebagai ion sulfat (iv) Di mana atom belerang dalam anion memiliki keadaan oksidasi +4. Anion sulfit adalah dasar konjugat bisulfit. Senyawa sulfit biasanya terjadi pada beberapa makanan dan juga di dalam tubuh manusia. Selain itu, sulfit berguna sebagai aditif makanan dan dapat membentuk benjolan saat terjadi bersama dengan sulfur dioksida dalam makanan.

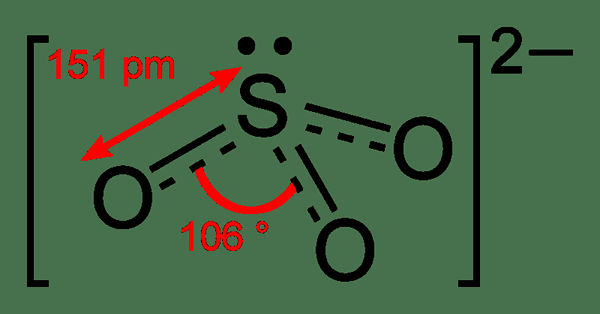
Gambar 01: Struktur anion sulfit
Ada tiga kemungkinan struktur resonansi untuk anion sulfit. Dalam setiap struktur resonansi, kita dapat mengamati bahwa atom sulfur terikat ganda ke salah satu dari tiga atom oksigen. Oleh karena itu, setiap struktur resonansi memiliki ikatan rangkap sulfur terhadap oksigen dengan muatan formal nol, sedangkan atom belerang terikat pada dua atom oksigen lainnya melalui ikatan tunggal. Oleh karena itu, dua atom oksigen lainnya membawa muatan formal -1 pada setiap atom oksigen. Muatan formal ini berkontribusi pada muatan keseluruhan (-2) dari anion sulfit. Ada pasangan elektron tunggal pada atom belerang. Oleh karena itu, geometri anion ini adalah piramidal trigonal.
Apa itu sulfur trioksida?
Sulfur trioksida adalah senyawa anorganik yang memiliki formula kimia SO3. Itu dianggap sebagai senyawa oksida ekonomi paling penting dari belerang. Zat ini dapat ada dalam beberapa bentuk: dalam keadaan gas, keadaan trimer kristal, dan polimer padat. Namun, ini tersedia secara komersial terutama sebagai padatan kristal putih yang tidak berwarna yang dapat asap di udara. Bau senyawa ini dapat bervariasi, tetapi membentuk uap yang pedas.
Kita dapat mengamati tiga struktur resonansi senyawa sulfur trioksida. Oleh karena itu, molekul aktual adalah struktur hibrida dari tiga struktur resonansi ini. Struktur hibrida memiliki geometri planar trigonal. Di sini, atom belerang berada di tengah molekul, dan memiliki keadaan oksidasi +6. Muatan formal pada atom belerang adalah nol. Struktur resonansi menunjukkan bahwa tiga sulfur ke ikatan kovalen oksigen sama dalam panjang ikatan.
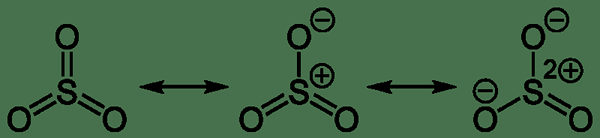
Gambar 02: Resonansi molekul sulfur trioksida
Bahan ini penting sebagai reagen dalam reaksi sulfonasi. Reaksi ini penting dalam pembuatan deterjen, pewarna, dan senyawa farmasi.
Apa perbedaan antara sulfit dan sulfur trioksida?
Istilah sulfit mengacu pada senyawa ionik yang mengandung anion sulfit yang terikat pada kation yang berbeda. Sulfur trioksida adalah senyawa anorganik yang memiliki formula kimia SO3. Perbedaan utama antara sulfit dan sulfur trioksida adalah bahwa sulfit adalah senyawa ionik yang memiliki anion sulfat (IV), sedangkan sulfur trioksida adalah senyawa non-ionik.
Infografis di bawah ini mencantumkan perbedaan antara sulfit dan sulfur trioksida dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -sulfit vs sulfur trioksida
Istilah sulfit mengacu pada senyawa ionik yang mengandung anion sulfit yang terikat pada kation yang berbeda. Sulfur trioksida adalah senyawa anorganik yang memiliki formula kimia SO3. Perbedaan utama antara sulfit dan sulfur trioksida adalah bahwa sulfit adalah senyawa ionik yang memiliki anion sulfat (IV), sedangkan sulfur trioksida adalah senyawa non-ionik.
Referensi:
1. “Sulfur trioksida." Pusat Nasional Informasi Bioteknologi. Basis Data Senyawa Pubchem, U.S. Perpustakaan Kedokteran Nasional.
Gambar milik:
1. “Sulfite-ion-2D-dimensi” (domain publik) via Commons Wikimedia
2. "SO3 Meso" oleh Yikrazuul - karya sendiri (domain publik) melalui Commons Wikimedia


