Perbedaan antara orbital 1S dan 2S

Perbedaan utama - orbital 1s vs 2s
Atom adalah unit materi terkecil. Dengan kata lain, semua materi terbuat dari atom. Atom terdiri dari partikel subatomik, terutama, proton, elektron, dan neutron. Proton dan elektron membuat nukleus, yang terletak di tengah atom. Tetapi elektron diposisikan dalam orbital (atau tingkat energi) yang terletak di luar nukleus atom. Penting juga untuk dicatat bahwa orbital adalah konsep hipotetis yang digunakan untuk menjelaskan lokasi atom yang paling mungkin. Ada berbagai orbital di sekitar nukleus. Ada juga sub-orbital seperti S, P, D, F, dll. Sub-orbital S berbentuk bulat ketika dianggap sebagai struktur 3D. Orbital S memiliki probabilitas tertinggi untuk menemukan elektron di sekitar nukleus. Sub-orbital sekali lagi diberi nomor sebagai 1s, 2s, 3s, dll. Menurut tingkat energi. Perbedaan utama antara orbital 1S dan 2S adalah energi dari masing -masing orbital. Orbital 1s memiliki energi yang lebih rendah daripada orbital 2S.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu orbital 1s
3. Apa orbital 2s
4. Perbandingan berdampingan - orbital 1s vs 2s
5. Ringkasan
Apa itu orbital 1s?
Orbital 1s adalah orbital yang paling dekat dengan nukleus. Itu memiliki energi terendah di antara orbital lainnya. Itu juga bentuk bulat terkecil. Oleh karena itu, jari -jari orbital S kecil. Hanya ada 2 elektron dalam orbital S. Konfigurasi elektron dapat ditulis sebagai 1s1, Jika hanya ada satu elektron dalam orbital S. Tetapi jika ada sepasang elektron, itu bisa ditulis sebagai 1s2. Kemudian dua elektron dalam orbital S bergerak ke arah yang berlawanan karena tolakan yang terjadi karena muatan listrik yang sama dari dua elektron. Ketika ada elektron yang tidak berpasangan, itu disebut paramagnetik. Itu karena bisa tertarik dengan magnet. Tetapi jika orbital diisi dan sepasang elektron hadir, elektron tidak dapat ditarik oleh magnet; ini dikenal sebagai diamagnetik.
Apa orbital 2s?
Orbital 2s lebih besar dari orbital 1s. Oleh karena itu, jari -jarinya lebih besar dari orbital 1s. Ini adalah orbital lemari berikutnya ke nukleus setelah orbital 1s. Energinya lebih tinggi dari orbital 1s tetapi lebih rendah dari orbital lain dalam atom. Orbital 2s juga hanya dapat diisi dengan satu atau dua elektron. Tetapi orbital 2s diisi dengan elektron hanya setelah penyelesaian orbital 1s. Ini disebut prinsip aufbau, yang menunjukkan urutan pengisian elektron ke dalam sub-orbital.
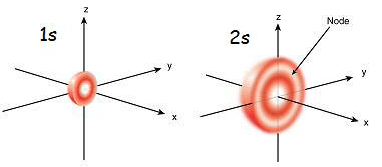
Gambar 01: orbital 1s dan 2s
Apa perbedaan antara orbital 1s dan 2s?
Orbital 1s vs 2s | |
| Orbital 1s adalah orbital terdekat dengan nukleus. | Orbital 2s adalah orbital terdekat kedua dengan nukleus. |
| Tingkat energi | |
| Energi orbital 1s lebih rendah dari orbital 2s. | 2s memiliki energi yang relatif lebih tinggi. |
| Jari -jari orbital | |
| Jari -jari orbital 1S lebih kecil. | Jari -jari orbital 2s relatif besar. |
| Ukuran orbital | |
| Orbital 1s memiliki bentuk bulat terkecil. | Orbital 2s lebih besar dari orbital 1S. |
| Pengisian elektron | |
| Elektron pertama kali diisi dalam orbital 1S. | Orbital 2s diisi hanya setelah menyelesaikan elektron di orbital 1S. |
Ringkasan -orbital 1s vs 2s
Atom adalah struktur 3D yang mengandung inti di tengah yang dikelilingi oleh orbital berbentuk beragam dari tingkat energi yang berbeda. Orbital ini sekali lagi dibagi menjadi sub-orbital sesuai dengan sedikit perbedaan energi. Elektron, yang merupakan partikel subatomik utama dari suatu atom terletak di tingkat energi ini. Sub-orbital 1S dan 2S paling dekat dengan nukleus. Perbedaan utama antara orbital 1S dan 2S adalah perbedaan tingkat energinya, yaitu, orbital 2S adalah tingkat energi yang lebih tinggi dari orbital 1S.
Referensi:
1. Libretexts. “Orbital Atom.”Libreteks Kimia. Libretexts, 03 Nov. 2015. Web. 26 Mei 2017. .
2. Atom, elektron dan orbital. N.P., N.D. Web. 26 Mei 2017. .
Gambar milik:
1. “S orbital” (dipotong) oleh CK -12 Foundation - File: Kimia Sekolah Menengah.PDF, halaman 265 (CC BY-SA 3.0) Via Commons Wikimedia


