Perbedaan antara asam asetat dan asetat
Perbedaan Utama - Asam Asetat vs Asetat
Perbedaan utama antara asam asetat dan asetat adalah itu Asam asetat adalah senyawa netral sedangkan asetat adalah anion yang memiliki muatan listrik negatif bersih.
Asam asetat adalah senyawa organik yang membantu memproduksi cuka sedangkan ion asetat adalah basa konjugat dari asam asetat. Yang paling penting, pembentukan ion asetat terjadi dengan menghilangkan atom hidrogen pada gugus karboksilat asam asetat.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam asetat
3. Apa itu asetat
4. Perbandingan berdampingan - asam asetat vs asetat dalam bentuk tabel
5. Ringkasan
Apa itu asam asetat?
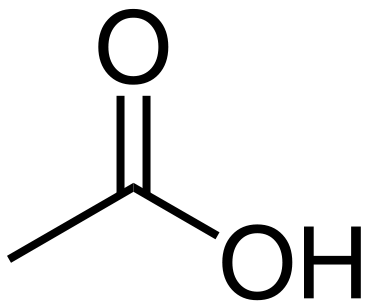
Asam asetat adalah senyawa organik yang memiliki formula kimia Ch3Cooh. Massa molar senyawa ini adalah 60 g/mol sedangkan nama IUPAC dari senyawa ini Asam etanoat. Selain itu, pada suhu kamar, asam asetat adalah cairan yang tidak berwarna dengan rasa asam. Asam asetat dikategorikan sebagai asam karboksilat sebagai hasil dari keberadaan gugus asam karboksilat (-cooh).

Gambar 1: Molekul Asam Asetat
Asam asetat glasial adalah bentuk asam asetat terkonsentrasi. Selain itu, asam asetat memiliki bau pedas, yang mirip dengan bau cuka dan rasa asam yang khas juga. Ini juga merupakan asam lemah karena disosiasi sebagian dalam larutan berair, melepaskan anion asetat dan proton. Asam asetat memiliki satu proton yang dapat dipisahkan per molekul. Namun, asam glasial adalah iritasi yang sangat korosif.
Asam asetat adalah asam karboksilat sederhana; Faktanya, itu adalah asam karboksilat paling sederhana kedua. Dalam keadaan padat asam asetat, molekul membentuk rantai molekul melalui ikatan hidrogen. Namun, dalam fase uap asam asetat, ia membentuk dimer (dua molekul yang terhubung satu sama lain melalui ikatan hidrogen). Karena asam asetat cair adalah pelarut protik polar, ia dapat larut dengan banyak pelarut polar dan nonpolar.
Apa itu asetat?
Asetat adalah anion yang terbentuk dari pengangkatan atom hidrogen dari asam asetat. Anion ini memiliki muatan negatif bersih (muatannya -1 sebagai hasil dari pelepasan satu proton). Ion asetat tidak bisa tetap sebagai senyawa individu karena muatannya, yang sangat reaktif. Dengan demikian, sebagian besar ada sebagai garam logam alkali. Ion asetat adalah basa konjugat asam asetat, yang akibatnya terbentuk dari disosiasi asam asetat.
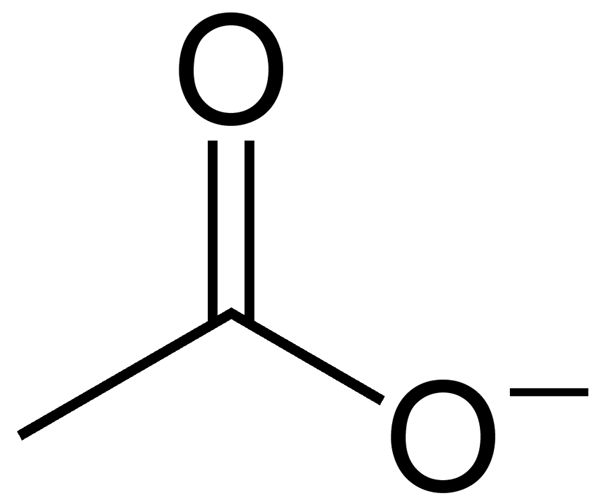
Gambar 2: anion asetat
Formula kimia anion ini C2H3HAI2- ketika Nama IUPAC -nya etanoat. Selanjutnya, massa molar asetat adalah 59 g/mol. Khususnya, pada nilai pH di atas 5.5, asam asetat ada sebagai anion asetat, melepaskan proton secara spontan. Ini karena, pada pH tinggi, ion asetat stabil dari asam asetat.
Apa perbedaan antara asam asetat dan asetat?
Asam asetat vs asetat | |
| Asam asetat adalah senyawa organik yang memiliki formula kimia ch3Cooh. | Asetat adalah anion yang terbentuk dari pengangkatan atom hidrogen dari asam asetat. |
| Masa molar | |
| Massa molar asam asetat adalah 60 g/mol. | Tetapi massa molar asetat adalah 59 g/mol. |
| Muatan listrik | |
| Asam asetat tidak memiliki muatan bersih. | Asetat memiliki muatan negatif. |
| Kategori | |
| Asam asetat adalah molekul organik. | Asetat adalah anion organik. |
| ph | |
| Molekul asam asetat stabil pada nilai pH rendah (sekitar pH 5). | Ion asetat stabil pada nilai pH tinggi (lebih tinggi dari pH 5.5). |
Ringkasan -Asam Asetat vs Asetat
Asam asetat adalah asam karboksilat paling sederhana kedua. Asetat, di sisi lain, adalah anion yang berasal dari asam asetat. Perbedaan utama antara asam asetat dan asetat adalah bahwa asam asetat adalah senyawa netral sedangkan asetat adalah anion yang memiliki muatan listrik negatif bersih.
Referensi:
1. "Asam asetat.”Wikipedia, 18 Apr. 2018, tersedia di sini.
2. "Asam asetat."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional, tersedia di sini.
3. "Asetat.”Wikipedia, 10 Apr. 2018, tersedia di sini.
Gambar milik:
1. “Asetic-Acid-2D-Skeletal” (Domain Publik) melalui Commons Wikimedia
2. “Asetat-Anion-Canonical-Form-2D-Skeletal” (Domain Publik) via Commons Wikimedia


