Perbedaan antara asam dan basa
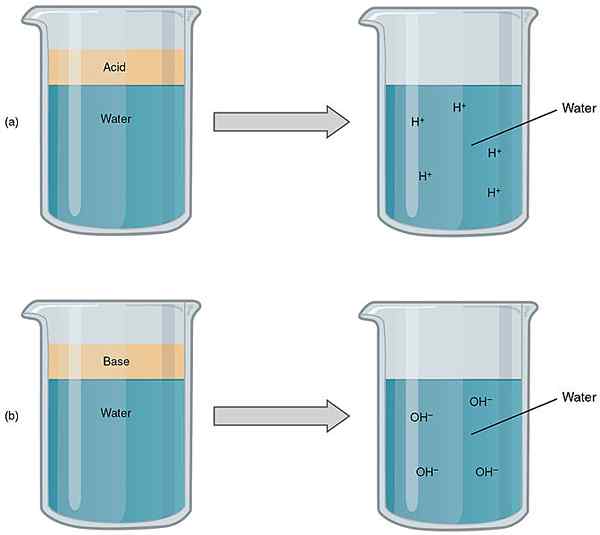
Perbedaan utama antara asam dan basa adalah itu Asam memiliki nilai pH mulai dari 1 hingga 7 sedangkan basa memiliki nilai pH mulai dari 7 hingga 14.
Nilai pH adalah logaritma minus dari h+ konsentrasi ion. pH 7 dianggap sebagai pH netral. Nilai pH lebih tinggi dari 7 menunjukkan adanya basa sedangkan nilai di bawah 7 menunjukkan adanya asam. Menurut teori lowry brønsted, asam dapat melepaskan h+ ion sedangkan basis dapat menerima h+ ion.

ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam
3. Apa itu basis
4. Perbandingan berdampingan - asam vs basa dalam bentuk tabel
5. Ringkasan
Apa itu asam?
Asam adalah zat yang memiliki pH kurang dari 7 dalam larutan berairnya. Kehadiran media asam dapat ditentukan dengan menggunakan kertas lakmus. Asam bisa menjadi biru lakmus menjadi. Namun, tidak ada perubahan warna jika lakmus merah digunakan. Senyawa yang memiliki atom hidrogen yang mudah terionisasi sering kali merupakan asam.
Menurut teori Brønsted-Lowry, asam adalah zat yang dapat melepaskan proton (h+ ion) ke media saat berada di media berair. Kapan h+ ion dilepaskan, ion -ion ini tidak bisa ada sendirian di media berair. Oleh karena itu ion -ion ini bergabung dengan molekul air, membentuk h3HAI+ ion (ion hidronium). Kehadiran ion hidronium, dengan demikian, menunjukkan adanya asam.
Menurut teori Arrhenius, asam adalah zat yang dapat meningkatkan jumlah ion hidronium dalam media berair. Ini terjadi karena meningkatnya h+ ion. Dengan kata lain, asam melepaskan h+ ion, yang dapat berinteraksi dengan molekul air untuk membentuk ion hidronium.
Saat mempertimbangkan teori Lewis, asam adalah senyawa yang mampu menerima sepasang elektron dari ikatan kimia kovalen. Berdasarkan definisi ini, zat yang tidak memiliki atom hidrogen juga dikategorikan sebagai asam karena kemampuannya untuk menerima pasangan elektron.
Sifat asam
Asam biasanya memiliki rasa asam. PH asam selalu kurang dari 7. Hampir semua asam memiliki bau yang terbakar. Tekstur asam lengket daripada licin. Selanjutnya, asam dapat bereaksi dengan logam (bahkan logam yang sangat tidak reaktif) untuk membentuk logam hidrida dan gas hidrogen.
Apa itu basis?
Basis adalah zat yang menunjukkan nilai pH lebih tinggi dari 7 saat dalam larutan berair. Basa dari suatu larutan menyebabkan warna lakmus merah berubah menjadi warna biru. Oleh karena itu, keberadaan basis dapat ditentukan dengan menggunakan lakmus merah. Namun, saat lakmus biru digunakan, tidak ada perubahan warna dengan alas. Senyawa yang memiliki gugus hidroksil yang mudah terionisasi sering menjadi pangkalan.
Menurut teori Brønsted-Lowry, sebuah basis adalah akseptor proton; Dengan kata lain, basis dapat menerima proton dari media berair. Namun, teori Arrhenius juga memberikan definisi yang sama: basis adalah zat yang mengurangi jumlah ion hidronium yang ada dalam suatu media. Konsentrasi ion hidronium menurun karena basa memperoleh h+ ion atau proton dari media berair. Ion -ion ini diperlukan untuk pembentukan ion hidronium.

Gambar 1: Perbandingan asam dan basa
Saat mempertimbangkan teori Lewis, basis adalah zat yang dapat menyumbangkan pasangan elektron. Zat -zat ini menyumbangkan pasangan elektron dan membentuk ikatan kovalen koordinat. Menurut teori ini, sebagian besar senyawa yang tidak memiliki kelompok oh menjadi pangkalan.
Sifat dasar
Pangkalan memiliki rasa pahit. Zat -zat ini selalu menunjukkan nilai pH lebih tinggi dari 7. Hampir semua pangkalan tidak berbau, kecuali untuk amonia. Amonia memiliki bau pedas. Tidak seperti asam, basa terasa licin. Basa dinetralkan saat bereaksi dengan asam.
Apa perbedaan antara asam dan basa?
Asam vs basa | |
| Asam adalah zat yang menunjukkan nilai pH lebih rendah dari 7 saat dalam larutan berair | Basis adalah zat yang menunjukkan nilai pH lebih tinggi dari 7 saat dalam larutan berair |
| Definisi berdasarkan teori lowry brønsted | |
| Asam adalah zat yang dapat melepaskan proton (ion H+) ke media saat berada dalam medium berair. | Basis adalah akseptor proton; Dengan kata lain, basis dapat menerima proton dari media berair. |
| Definisi berdasarkan teori arrhenius | |
| Asam adalah zat yang dapat meningkatkan jumlah ion hidronium dalam media berair. | Basis adalah zat yang dapat mengurangi jumlah ion hidronium dalam media berair. |
| Definisi berdasarkan teori lewis | |
| Asam adalah senyawa yang mampu menerima sepasang elektron dari ikatan kimia kovalen. | Basis adalah zat yang dapat menyumbangkan pasangan elektron. |
| Perubahan warna dalam lakmus | |
| Asam bisa menjadi lakmus biru menjadi merah, tetapi tidak ada perubahan warna pada lakmus merah. | Pangkalan bisa berubah menjadi biru lak, tetapi tidak ada perubahan warna pada lakmus biru. |
| Mencicipi | |
| AIDS memiliki rasa asam. | Pangkalan memiliki rasa pahit. |
| Bau | |
| Asam memiliki bau yang terbakar. | Basis tidak berbau, kecuali untuk amonia. |
| Ionisasi | |
| Asam dapat membentuk ion hidronium saat terionisasi. | Basis dapat membentuk ion hidroksil saat terionisasi. |
| Spesies kimia konjugasi | |
| Spesies konjugat asam adalah basa konjugatnya. | Spesies konjugat basa adalah asam konjugatnya. |
| Penetralan | |
| Asam dapat dinetralkan menggunakan basa. | Basa dapat dinetralkan menggunakan asam. |
| Titrasi | |
| Asam dititrasi dengan basa untuk netralisasi. | Basa bereaksi dengan asam untuk netralisasi. |
Ringkasan - asam vs basa
Semua senyawa dapat dikategorikan ke dalam asam, basa dan senyawa netral. Perbedaan utama antara asam dan basa adalah bahwa asam memiliki nilai pH mulai dari 1 hingga 7 sedangkan basa memiliki nilai pH mulai dari 7 hingga 14.
Referensi:
1. Helmenstine, Anne Marie. “Inilah asam dalam kimia."Thoughtco, tersedia di sini.
2. Helmenstine, Anne Marie. “Asam kunci dan basa definisi."Thoughtco, tersedia di sini.
3. Libretexts. “Gambaran Umum Asam dan Basa.”Kimia Libretexts, Libretexts, 13 Feb. 2017, tersedia di sini.
Gambar milik:
1. “215 Acids and Bases -01” oleh OpenStax College - Anatomy & Physiology, Situs Web Connexions, 19 Jun 2013 (CC oleh 3.0) Via Commons Wikimedia


