Perbedaan antara energi aktivasi dan energi ambang batas
Itu perbedaan utama antara energi aktivasi dan energi ambang batas adalah bahwa Energi aktivasi menggambarkan perbedaan energi potensial antara reaktan dan kompleks yang diaktifkan sedangkan energi ambang menggambarkan energi yang dibutuhkan oleh reaktan untuk bertabrakan satu sama lain dengan sukses untuk membentuk kompleks yang diaktifkan.
Energi adalah kemampuan untuk melakukan pekerjaan. Jika ada energi yang cukup, kita dapat menggunakan energi itu untuk melakukan beberapa pekerjaan yang kita inginkan; Dalam kimia, pekerjaan ini dapat berupa reaksi kimia atau reaksi nuklir. Energi aktivasi dan energi ambang adalah dua istilah yang kami gunakan dalam kimia untuk mendefinisikan dua bentuk energi yang berbeda.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu energi aktivasi
3. Apa itu energi ambang batas
4. Perbandingan Berdampingan - Energi Aktivasi Vs Energi Ambang Dalam Bentuk Tabel
5. Ringkasan
Apa itu energi aktivasi?
Energi aktivasi adalah bentuk energi yang kita butuhkan untuk mengaktifkan reaksi kimia atau nuklir atau reaksi lainnya. Sebagian besar waktu, kami mengukur bentuk energi ini di unit kilojoule per mol (kJ/mol). Bentuk energi ini adalah penghalang energi potensial yang menghindari reaksi kimia dari kemajuan. Ini berarti mencegah reaktan mengubah menjadi produk. Selain itu, untuk memajukan reaksi kimia dalam sistem termodinamika, sistem harus mencapai suhu tinggi yang cukup untuk memberikan reaktan energi yang sama atau lebih besar dari penghalang energi aktivasi.

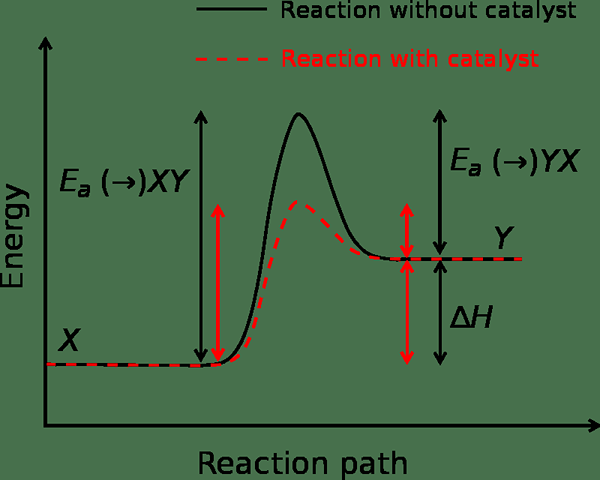
Gambar 01: Laju reaksi tanpa kehadiran dan adanya katalis
Jika sistem mendapatkan energi yang cukup, maka laju reaksi meningkat. Namun, dalam beberapa kasus, laju reaksi menurun ketika kita meningkatkan suhu. Ini karena energi aktivasi negatif. Kita dapat menghitung laju reaksi dan energi aktivasi menggunakan persamaan arrhenius. Ini sebagai berikut:
K = ae-EA/(Rt)
Di mana k adalah koefisien laju reaksi, A adalah faktor frekuensi untuk reaksi, R adalah konstanta gas universal dan t adalah suhu absolut. Lalu eA adalah energi aktivasi.
Selain itu, katalis adalah zat yang dapat menurunkan penghalang energi aktivasi untuk suatu reaksi. itu melakukannya dengan memodifikasi keadaan transisi reaksi. Selain itu, reaksi tidak mengkonsumsi katalis saat memajukan reaksi.
Apa itu energi ambang batas?
Energi ambang adalah energi minimum yang harus dimiliki sepasang partikel untuk menjalani tabrakan yang sukses. Istilah ini sangat berguna dalam fisika partikel daripada dalam kimia. Di sini, kita berbicara tentang energi kinetik partikel. Tabrakan partikel ini membentuk kompleks teraktivasi (menengah) dari suatu reaksi. Oleh karena itu, energi ambang sama dengan jumlah energi kinetik dan energi aktivasi. Oleh karena itu, bentuk energi ini selalu sama dengan atau lebih besar dari energi aktivasi.
Apa perbedaan antara energi aktivasi dan energi ambang batas?
Energi aktivasi adalah bentuk energi yang kita butuhkan untuk mengaktifkan reaksi kimia atau nuklir atau reaksi lainnya. Itu menggambarkan perbedaan energi potensial antara reaktan dan kompleks yang diaktifkan. Selain itu, nilainya selalu sama dengan atau lebih rendah dari energi ambang dari sistem termodinamika yang sama. Energi ambang batas, di sisi lain, adalah energi minimum yang harus dimiliki sepasang partikel untuk menjalani tabrakan yang sukses. Itu menggambarkan energi yang dibutuhkan oleh reaktan untuk bertabrakan satu sama lain untuk membentuk kompleks yang diaktifkan. Selain itu, nilai energi ini selalu sama dengan atau lebih besar dari energi aktivasi dari sistem termodinamika yang sama. Infografis di bawah ini menyajikan perbedaan antara energi aktivasi dan energi ambang dalam bentuk tabel.
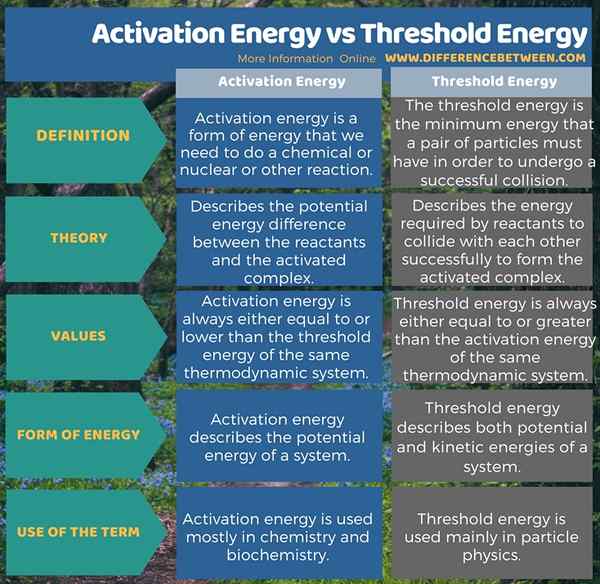
Ringkasan -Energi Aktivasi vs Energi Ambang
Kita dapat mendefinisikan energi ambang dan energi aktivasi untuk sistem termodinamika. Perbedaan utama antara energi aktivasi dan energi ambang adalah bahwa energi aktivasi menggambarkan perbedaan energi potensial antara reaktan dan kompleks yang diaktifkan sedangkan energi ambang menggambarkan energi yang dibutuhkan oleh reaktan untuk bertabrakan satu sama lain untuk membentuk kompleks yang diaktifkan yang diaktifkan.
Referensi:
1. “Energi aktivasi.”Wikipedia, Wikimedia Foundation, 27 Juli 2018. Tersedia disini
2. “Energi ambang.”Wikipedia, Wikimedia Foundation, 9 Agustus. 2018. Tersedia disini
Gambar milik:
1."Energi aktivasi" (domain publik) via commons wikimedia


