Perbedaan antara alotrop dan isotop
Itu perbedaan utama antara alotrop dan isotop adalah itu Allotrop dipertimbangkan pada tingkat molekuler sedangkan isotop dipertimbangkan pada tingkat atom.
Ada sekitar 118 elemen dalam tabel periodik sesuai dengan nomor atomnya. Elemen adalah zat kimia yang hanya terdiri dari satu jenis atom; Karenanya, mereka murni. Allotrop adalah bentuk yang berbeda dari senyawa yang sama sedangkan isotop adalah bentuk yang berbeda dari elemen yang sama.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu alotrop
3. Apa itu isotop
4. Perbandingan berdampingan - alotrop vs isotop dalam bentuk tabel
5. Ringkasan
Apa itu alotrop?
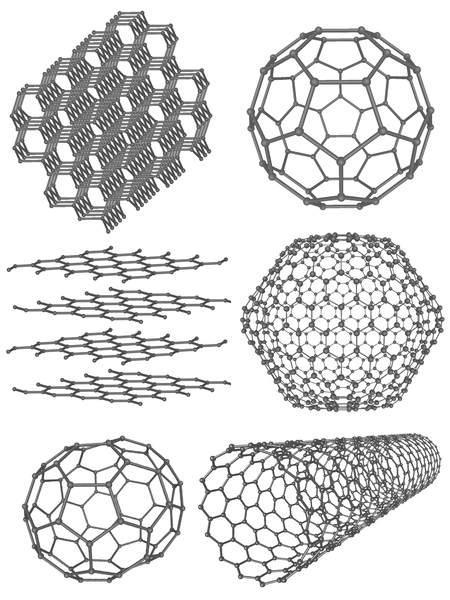
Alotrop adalah bentuk yang berbeda dari elemen yang sama di tingkat molekuler. Mereka menunjukkan sifat fisik yang berbeda. Di antara semua elemen kimia, karbon, oksigen, belerang dan fosfor adalah elemen utama yang memiliki alotrop. Karbon memiliki sejumlah besar alotrop. Delapan alotrop karbon sangat berbeda satu sama lain. Misalnya, berlian adalah alotrop karbon terkuat sedangkan grafit kurang kuat. Karbon nanotube, fullerene, dan karbon amorf adalah beberapa alotrop karbon lainnya.

Gambar 1: Alotrop karbon
Untuk oksigen elemen, ada dua alotrop umum sebagai O2 dan O3. O2 berlimpah dari O3. Biasanya, di alam, beberapa alotrop lebih banyak daripada yang lain karena stabilitasnya. Fosfor memiliki tiga alotrop sebagai fosfor merah, putih dan hitam. Dari ini, fosfor merah dan putih adalah yang paling umum. Alotrop berbeda satu sama lain karena pengaturan atom, jumlah atom, dll.
Apa itu isotop?
Isotop adalah berbagai bentuk atom dari elemen kimia yang sama. Mereka berbeda satu sama lain karena mereka memiliki jumlah neutron yang berbeda. Karena nomor neutron berbeda, jumlah massa mereka juga berbeda.
Namun, isotop dari elemen yang sama memiliki jumlah proton dan neutron yang sama. Isotop yang berbeda hadir dalam berbagai jumlah, dan kami dapat memberikan ini sebagai nilai persentase yang disebut kelimpahan relatif. Misalnya, hidrogen memiliki tiga isotop sebagai protium, deuterium dan tritium. Jumlah neutron dan kelimpahan relatif mereka adalah sebagai berikut.

Gambar 2: Isotop yang berbeda dari elemen kimia hidrogen
Jumlah neutron yang dapat ditahan oleh nukleus berbeda dari elemen ke elemen. Di antara isotop ini, hanya beberapa yang stabil. Misalnya, oksigen memiliki tiga isotop stabil, dan timah memiliki sepuluh isotop stabil. Sebagian besar waktu, elemen sederhana memiliki nomor neutron yang sama dengan nomor proton. Tapi, dalam elemen berat, ada lebih banyak neutron daripada proton. Jumlah neutron penting untuk menyeimbangkan stabilitas inti. Ketika inti terlalu berat, mereka menjadi tidak stabil; Oleh karena itu, isotop itu menjadi radioaktif. Misalnya, 238U memancarkan radiasi dan meluruh ke inti yang jauh lebih kecil. Isotop mungkin memiliki sifat yang berbeda karena massa yang berbeda. Misalnya, mereka mungkin memiliki putaran yang berbeda; dengan demikian spektrum NMR mereka berbeda. Namun, jumlah elektron mereka serupa, menimbulkan perilaku kimia yang serupa.
Apa perbedaan antara alotrop dan isotop?
Alotrop adalah bentuk yang berbeda dari elemen yang sama di tingkat molekuler. Isotop adalah berbagai bentuk atom dari elemen kimia yang sama. Perbedaan utama antara alotrop dan isotop adalah bahwa allotrop dipertimbangkan pada tingkat molekuler, sedangkan isotop dipertimbangkan pada tingkat atom. Selain itu, perbedaan lebih lanjut antara alotrop dan isotop adalah bahwa alotrop berbeda satu sama lain pada cara atom diatur sementara isotop berbeda satu sama lain dalam jumlah neutron.
Infografis di bawah ini menunjukkan lebih banyak detail tentang perbedaan antara alotrop dan isotop.

Ringkasan -allotrop vs isotop
Meskipun istilah alotrop dan isotop terdengar serupa, mereka sangat berbeda satu sama lain sesuai dengan artinya. Perbedaan utama antara alotrop dan isotop adalah bahwa allotrop dipertimbangkan pada tingkat molekuler, sedangkan isotop dipertimbangkan pada tingkat atom.
Referensi:
1. Helmenstine, Anne Marie, “Definisi dan contoh allotrope."Thoughtco, Jan. 13, 2019, tersedia di sini.
2. Helmenstine, Anne Marie, “Definisi dan contoh isotop dalam kimia."Thoughtco, OCT. 22, 2018, tersedia di sini.
Gambar milik:
1. "Allotropes of Carbon" oleh MStroeck (Talk) (Unggah) - Pekerjaan Sendiri (CC BY -SA 3.0) Via Commons Wikimedia


