Perbedaan antara massa atom dan massa atom rata -rata
Itu perbedaan utama antara massa atom dan massa atom rata -rata adalah bahwa Massa atom adalah massa atom, sedangkan massa atom rata -rata adalah massa atom dari elemen kimia tertentu yang dihitung dengan mempertimbangkan isotop elemen tersebut.
Kami sering menggunakan istilah massa atom dan rata -rata massa atom secara bergantian; Namun, mereka adalah dua istilah yang berbeda.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu massa atom
3. Apa itu massa atom rata -rata
4. Perbandingan berdampingan - massa atom vs massa atom rata -rata dalam bentuk tabel
5. Ringkasan
Apa itu massa atom?
Massa atom adalah massa total nukleon yang ada dalam inti atom. Nukleon adalah P7P atau neutron. Oleh karena itu, massa atom adalah massa total proton dan neutron yang ada dalam nukleus. Meskipun elektron juga ada dalam atom, massa elektron tidak digunakan dalam perhitungan karena elektron sangat kecil dan memiliki massa yang dapat diabaikan jika dibandingkan dengan proton dan neutron.
Tidak seperti dalam massa atom relatif, di sini kami menghitung massa masing -masing dan setiap atom tanpa menghitung nilai rata -rata apa pun. Oleh karena itu, kami mendapatkan nilai yang berbeda untuk massa atom dari isotop yang berbeda. Itu karena jumlah nukleon yang ada dalam isotop dari elemen yang sama berbeda satu sama lain.

Mari kita pertimbangkan contoh:
Massa atom hidrogen = 2
Jadi, massa atom isotop hidrogen-2 (deuterium) dihitung sebagai berikut.
Jumlah proton dalam nukleus = 1
Jumlah neutron dalam nukleus = 1
Oleh karena itu, massa atom hidrogen = (1 amu + 1 amu) = 2 amu
Di sini, massa atom diberikan oleh unit Amu (unit massa atom). Satu proton atau neutron memiliki massa 1 amu.
Apa itu massa atom rata -rata?
Massa atom rata -rata adalah massa atom elemen kimia tertentu yang dihitung dengan mempertimbangkan isotop elemen tersebut. Dalam hal ini, nilai massa tergantung pada kelimpahan alami dari elemen kimia.
Ada dua langkah untuk menghitung massa atom rata -rata.
- Lipat gandakan massa atom masing -masing isotop dari kelimpahan alami (mengambil kelimpahan sebagai persentase) secara terpisah.
- Tambahkan nilai yang diperoleh bersama -sama untuk mendapatkan massa atom rata -rata.
Mari kita pertimbangkan contoh:
Ada dua isotop karbon sebagai karbon-12 dan karbon-13. Kelimpahan mereka masing -masing adalah 98% dan 2. Maka kita dapat menentukan massa atom rata -rata karbon menggunakan perhitungan. Di sini, kita harus melipatgandakan massa atom dari setiap isotop dengan nilai kelimpahan. Kemudian, kita perlu mengambil kelimpahan sebagai nilai dua desimal, bukan sebagai persentase. Selanjutnya, kita dapat menambahkan nilai yang diperoleh.
Karbon-12: 0.98*12 = 11.76
Karbon-13: 0.02*13 = 0.26
Kemudian, massa karbon atom rata -rata adalah = 11.76+0.26 = 12.02 g/mol.
Apa perbedaan antara massa atom dan massa atom rata -rata?
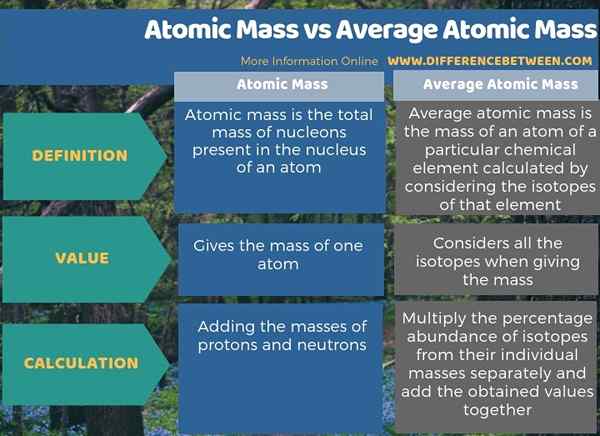
Meskipun istilah massa atom dan massa atom rata -rata terdengar serupa, mereka adalah dua istilah yang berbeda. Perbedaan utama antara massa atom dan massa atom rata -rata adalah bahwa massa atom adalah massa atom, sedangkan massa atom rata -rata adalah massa atom dari elemen kimia tertentu yang dihitung dengan mempertimbangkan isotop dari elemen tersebut. Istilah massa atom mengacu pada massa atom tunggal sedangkan istilah massa atom rata -rata mengacu pada massa elemen kimia.
Ringkasan -Massa atom vs massa atom rata -rata
Massa atom mengacu pada massa atom tunggal, tetapi massa atom rata -rata mengacu pada massa rata -rata atom dari elemen kimia tertentu. Oleh karena itu, perbedaan utama antara massa atom dan massa atom rata -rata adalah bahwa massa atom adalah massa atom, sedangkan massa atom rata -rata adalah massa atom elemen kimia tertentu yang dihitung dengan mempertimbangkan isotop dari elemen tersebut.
Referensi:
Helmenstine, Anne Marie. “Cara menghitung massa atom."Thoughtco, Aug. 21, 2019, tersedia di sini.
Helmenstine, Anne Marie. “Cara menghitung massa atom."Thoughtco, Aug. 21, 2019, tersedia di sini.
Gambar milik:
1. “Atom bergaya dengan tiga orbit model bohr dan nukleus bergaya” oleh SVG oleh malas. Recoloring dan menyetrika beberapa gangguan yang dilakukan oleh Rainer Klute. - Pekerjaan sendiri berdasarkan: gambar: atom lithium bergaya.PNG oleh Halfdan (CC BY-SA 3.0) Via Commons Wikimedia


