Perbedaan antara massa atom dan berat molekul
Itu perbedaan utama antara massa atom dan berat molekul adalah bahwa Massa atom adalah massa atom tunggal sedangkan berat molekul adalah jumlah berat atom dalam molekul.
Atom adalah blok bangunan dari semua materi. Atom memiliki berat; itu adalah massa atom. Atom dapat bergabung dalam berbagai kombinasi, untuk membentuk molekul dan senyawa lainnya. Struktur molekul memberikan rasio atom yang tepat; Dengan demikian, kita dapat menulis rumus molekuler untuk senyawa. Ini penting dalam menentukan berat molekul.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu massa atom
3. Apa itu berat molekul
4. Perbandingan berdampingan - massa atom vs berat molekul dalam bentuk tabel
5. Ringkasan
Apa itu massa atom?
Atom terutama mengandung proton, neutron dan elektron. Massa atom hanyalah massa atom. Dengan kata lain, ini adalah kumpulan massa dari semua neutron, proton dan elektron dalam satu atom, khususnya, ketika atom tidak bergerak (massa istirahat). Kami mengambil massa saat istirahat karena, menurut dasar -dasar fisika, ketika atom bergerak dengan kecepatan yang sangat tinggi, massa meningkat.
Namun, massa elektron sangat kecil dibandingkan dengan massa proton dan neutron. Oleh karena itu, kita dapat mengatakan bahwa kontribusi elektron terhadap massa atom lebih sedikit. Sebagian besar atom dalam tabel periodik memiliki dua atau lebih isotop. Isotop berbeda satu sama lain dengan memiliki jumlah neutron yang berbeda, meskipun mereka memiliki jumlah proton dan elektron yang sama. Karena jumlah neutron mereka berbeda, setiap isotop memiliki massa atom yang berbeda.

Gambar 01: Massa atom elemen kimia
Selain itu, massa atom sangat kecil; Dengan demikian, kami tidak dapat mengekspresikannya dalam unit massa normal seperti gram atau kilogram. Untuk tujuan kami, kami menggunakan unit unit atom unit atom (AMU) untuk mengukur massa atom. 1 Unit Massa Atom adalah seperempat dari massa isotop C-12. Ketika kita membagi massa atom dengan massa seperempat dari massa isotop C-12, kita bisa mendapatkan massa relatifnya. Namun, dalam penggunaan umum ketika kita mengatakan massa atom relatif dari suatu unsur, kita maksudkan berat atom mereka (karena kita menghitungnya dengan mempertimbangkan semua isotop).
Apa itu berat molekul?
Berat molekul adalah kumpulan berat semua atom dalam molekul. Unit SI dari parameter ini adalah GMOL-1. Ini memberikan jumlah atom/molekul/senyawa yang ada dalam satu mol zat. Dengan kata lain, itu adalah massa avogadro dari atom/molekul atau senyawa.
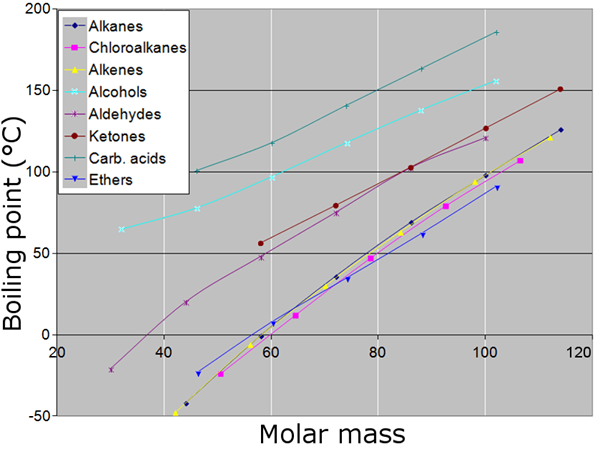
Gambar 02: titik didih dan massa molar (berat molekul) dari senyawa yang berbeda
Penting untuk mengukur berat atom dan molekul dalam skenario praktis. Tetapi sulit untuk menimbangnya sebagai partikel individu, karena massa mereka sangat kecil sesuai dengan parameter penimbangan normal (gram atau kilogram). Oleh karena itu, untuk memenuhi kesenjangan ini dan mengukur partikel dalam tingkat makroskopik, konsep massa molar sangat berguna.
Definisi berat molekul secara langsung berkaitan dengan isotop karbon-12. Massa satu mol karbon 12 atom persis 12 gram, yang merupakan massa molar persis 12 gram per mol. Selain itu, kita dapat menghitung berat molekul molekul yang mengandung atom yang sama seperti O2 atau n2 dengan mengalikan jumlah atom dengan berat atom atom. Namun, berat molekul senyawa seperti NaCl atau CUSO4 dihitung dengan menambahkan bobot atom dari masing -masing atom.
Apa perbedaan antara massa atom dan berat molekul?
Massa atom memberikan massa atom sementara berat molekul memberikan massa molekul. Namun, perbedaan utama antara massa atom dan berat molekul adalah bahwa massa atom adalah massa atom tunggal sedangkan berat molekul adalah jumlah berat atom dalam molekul. Sebagai perbedaan signifikan lainnya antara massa atom dan berat molekul, unit pengukuran massa atom adalah Amu sedangkan unit untuk berat molekul adalah G/mol.
Selain itu, ada perbedaan antara massa atom dan berat molekul dalam cara kita menghitung dua kuantitas ini. Kita dapat menentukan massa atom dengan mudah melalui menambahkan massa neutron, proton dan elektron atom. Namun, kami menentukan massa molekul atau berat molekul molekul melalui menambahkan massa rata -rata atom dalam molekul.
Ilustrasi di bawah ini menyajikan perbedaan antara massa atom dan berat molekul dalam bentuk tabel.
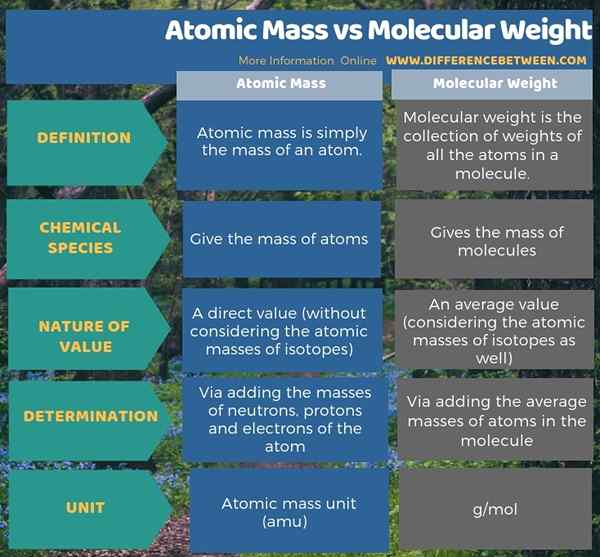
Ringkasan -Massa atom vs berat molekul
Kami menggunakan istilah massa atom dan berat molekul terutama dalam perhitungan kimia umum untuk menentukan nilai -nilai mengenai reaksi kimia; seperti jumlah reaktan, produk, dll. Perbedaan utama antara massa atom dan berat molekul adalah bahwa massa atom adalah massa atom tunggal sedangkan berat molekul adalah jumlah berat atom dalam molekul.
Referensi:
1.Helmenstine, Anne Marie, PH.D. “Cara menghitung massa atom."Thoughtco, dec. 5, 2018. Tersedia disini
Gambar milik:
1.”Tabel Periodik Elemen Massa Atom Black and White” oleh DMARCUS100 - Pekerjaan Sendiri, (CC BY -SA 4.0) Via Commons Wikimedia
2."Boiling Point vs Molar Massa Grafik" oleh JPTA - Karya Sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


