Perbedaan antara angka kuantum azimuthal dan prinsipal
Itu perbedaan utama antara azimuthal dan angka kuantum utama adalah itu Nomor kuantum azimut menggambarkan momentum sudut elektron dalam atom sedangkan angka kuantum utama menggambarkan ukuran orbital elektron.
Angka kuantum adalah nilai yang penting dalam menggambarkan tingkat energi atom. Ada empat angka kuantum yang dapat kita gunakan untuk menggambarkan posisi elektron dalam atom. Mereka adalah angka kuantum utama, angka kuantum azimut, angka kuantum magnetik dan angka kuantum putar.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Berapa angka kuantum azimuthal
3. Berapa angka kuantum utama
4. Perbandingan berdampingan - Azimuthal vs nomor kuantum utama dalam bentuk tabel
5. Ringkasan
Berapa angka kuantum azimuthal?
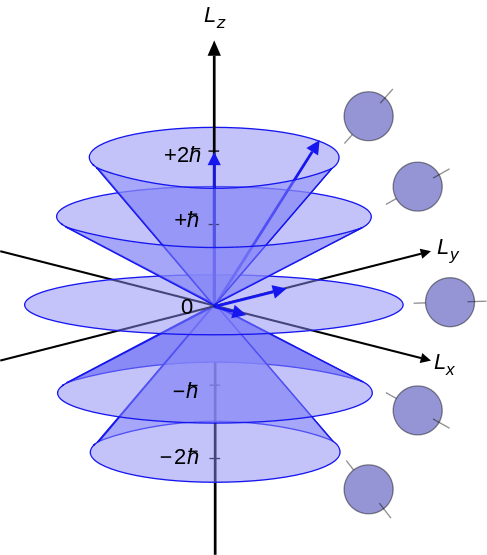
Angka kuantum azimut adalah angka kuantum yang menggambarkan momentum sudut elektron dalam atom. Oleh karena itu, kita juga dapat menyebutnya nomor kuantum momentum sudut orbital. Surat "l“Menunjukkan nomor kuantum azimuthal. Selain itu, angka kuantum ini menentukan bentuk orbital di mana elektron ada. Ini adalah yang kedua dari set empat angka kuantum. Dengan demikian, kita dapat menyebutkannya sebagai angka kuantum kedua juga (karena empat angka kuantum menggambarkan keadaan kuantum elektron dalam atom). Persamaan yang dapat menghubungkan angka kuantum azimut dengan momentum sudut adalah sebagai berikut:
L2Ψ =H2l(l+1) ψ
Dimana l2 adalah operator momentum sudut orbital, ψ adalah fungsi gelombang dari elektron dan H adalah konstanta papan yang dikurangi. Di Sini, SAYA selalu menjadi bilangan bulat positif. Menurut mekanika kuantum, setiap tingkat energi memiliki subshells yang berbeda. Subskil ini berbeda satu sama lain dalam bentuk dan orientasinya. Subsan tingkat energi dinamai sebagai -SAYA, 0 dan +l.
| Nomor azimut | Denotasi | Jumlah orbital | Jumlah elektron maksimum |
| 0 | S | 1 | 2 |
| 1 | P | 3 (= -1, 0, +1) | 6 |
| 2 | D | 5 (= -2, -1, 0, +1, +2) | 10 |
| 3 | F | 7 (= -3, -2, -1, 0, +1, +2, +3) | 14 |

Gambar 02: Angka kuantum azimut mulai dari -l, 0 hingga +l
Berapa angka kuantum utama?
Angka kuantum utama adalah angka kuantum yang menggambarkan tingkat energi utama di mana elektron ada. Kita dapat menunjukkannya sebagai "n". Karena ini adalah yang pertama dari empat angka kuantum yang berbeda; kita juga bisa menyebutnya nomor kuantum pertama. Nilai angka kuantum utama adalah bilangan bulat positif mulai dari 1, i.e. n = 1, 2, 3,…
Lebih tinggi nilai angka kuantum utama, lebih tinggi energi elektron; Dengan demikian, elektron terikat secara longgar ke atom. Itu berarti; Nilai “N” yang tinggi mengacu pada tingkat energi yang lebih tinggi. Selain itu, untuk setiap nilai "n", ada nilai terpisah untuk angka kuantum azimut, angka kuantum magnetik dan angka kuantum putar. Itu karena setiap tingkat energi masing -masing memiliki subsksen, orbital, dan pasangan elektron sendiri.
Apa perbedaan antara angka kuantum azimuthal dan prinsipal?
Angka kuantum adalah nilai yang penting dalam menggambarkan tingkat energi atom. Ada empat angka kuantum yang berbeda, dan dua yang pertama adalah angka kuantum utama dan angka kuantum azimut. Perbedaan utama antara angka kuantum azimut dan prinsipal adalah bahwa angka kuantum azimut menggambarkan momentum sudut elektron dalam atom, sedangkan angka kuantum utama menggambarkan ukuran orbital elektron. Kita dapat menunjukkan angka kuantum azimut sebagai “l"Dan nomor kuantum utama sebagai" n ".
Selain itu, angka kuantum azimut menggambarkan momentum sudut dan bentuk orbital, sedangkan angka kuantum utama menggambarkan tingkat energi di mana elektron ada.
Di bawah infografis merangkum perbedaan antara angka kuantum azimuthal dan prinsipal.
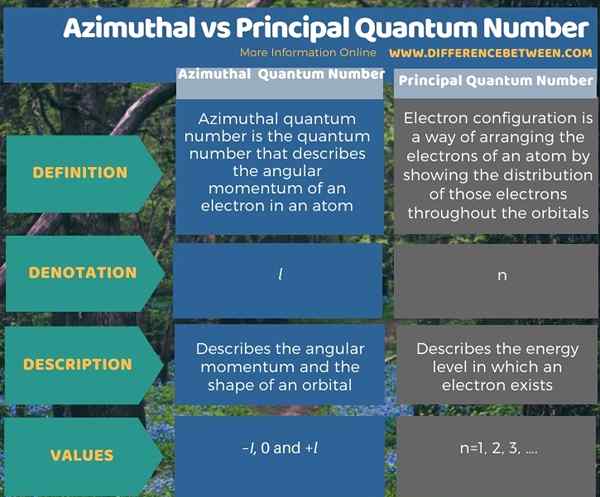
Ringkasan -Azimuthal vs Nomor kuantum utama
Angka kuantum adalah nilai yang menggambarkan tingkat energi atom. Ada empat angka kuantum yang berbeda, dan dua yang pertama adalah angka kuantum utama dan angka kuantum azimut. Perbedaan utama antara angka kuantum azimut dan prinsipal adalah bahwa angka kuantum azimut menggambarkan momentum sudut elektron dalam atom, sedangkan angka kuantum utama menggambarkan ukuran orbital elektron.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Angka Kuantum Azimuthal."Thoughtco, Jun. 22, 2018, tersedia di sini.
2. Helmenstine, Anne Marie. “Definisi Angka Kuantum Utama."Thoughtco, Nov. 6, 2019, tersedia di sini.
Gambar milik:
1. “Model Vektor Momentum Sudut Orbital” oleh Maschen - Karya Sendiri (Domain Publik) Via Commons Wikimedia


