Perbedaan antara momen ikatan dan momen dipol
Perbedaan Utama - Momen Bond vs Momen Dipol
Istilah momen ikatan dan momen dipol didasarkan pada prinsip yang sama tetapi berbeda berdasarkan aplikasi. Momen ikatan juga dikenal sebagai momen dipol ikatan. Itu adalah polaritas ikatan kimia yang terletak di dalam molekul tertentu. Momen dipol, di sisi lain, adalah segala jenis pemisahan listrik (pemisahan muatan). Perbedaan utama antara momen ikatan dan momen dipol adalah itu Momen ikatan terjadi dalam ikatan kimia kovalen sedangkan momen dipol terjadi antara dua ion dalam ikatan ionik atau antara dua atom dalam ikatan kovalen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu momen ikatan
3. Apa itu momen dipol
4. Kesamaan antara momen ikatan dan momen dipol
5. Perbandingan berdampingan - momen ikatan vs dipol momen dalam bentuk tabel
6. Ringkasan
Apa itu momen ikatan?
Momen ikatan adalah pemisahan muatan listrik dalam ikatan kimia kovalen yang ada dalam senyawa kimia tertentu. Oleh karena itu, itu memberikan polaritas ikatan kimia. Momen ikatan terjadi ketika ada pemisahan muatan positif dan negatif dalam ikatan kimia. Momen dipol ikatan dilambangkan dengan simbol "μ".
μ = ΔD
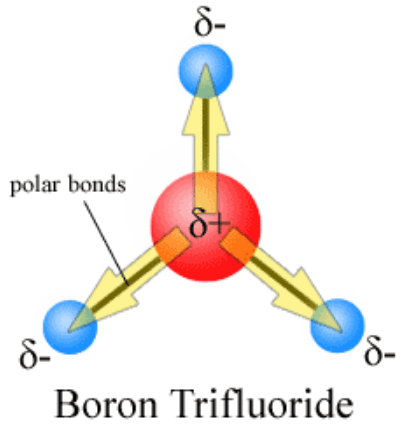
di mana, Δ adalah nilai muatan dan d adalah jarak antara dua atom dalam ikatan kovalen. Dalam penciptaan momen dipol ikatan, muatan listrik dipisahkan sebagai muatan parsial Δ+ dan Δ-. Pemisahan muatan ini terjadi dalam ikatan kimia ketika dua atom yang berpartisipasi dalam pembentukan ikatan memiliki nilai elektronegativitas yang berbeda. Karena elektronegativitas atom adalah afinitas elektron, lebih banyak atom elektronegatif menarik elektron ikatan ke arah mereka. Kemudian, atom dengan nilai elektronegatif yang kurang mendapat muatan positif parsial karena kepadatan elektron di sekitar atom itu lebih sedikit. Sejalan dengan itu, atom yang memiliki elektronegativitas tinggi mendapat muatan negatif parsial.

Gambar 1: Polaritas Boron Trifluoride (BF3)
Unit SI untuk pengukuran momen dipol ikatan adalah Coulomb-Meter (C M). Molekul diatomik hanya memiliki satu ikatan kovalen. Oleh karena itu, momen dipol ikatan molekul diatomik mirip dengan momen dipol molekul. Momen dipol molekul untuk molekul diatomik yang mengandung dua atom yang sama adalah nol, i.e., momen dipol molekul CL2 adalah nol. Tetapi senyawa ionik yang sangat seperti KBR memiliki momen ikatan yang tinggi dan momen molekuler. Untuk molekul polyatomic yang kompleks, ada banyak ikatan kovalen. Kemudian momen dipol molekuler ditentukan oleh semua momen dipol ikatan individu.
Apa itu momen dipol?
Momen dipol adalah pemisahan muatan listrik. Pemisahan muatan dapat terjadi antara dua ion dalam ikatan ionik atau dua atom dalam ikatan kimia kovalen. Momen dipol muncul karena perbedaan antara nilai elektronegativitas dari atom yang berbeda yang membentuk ikatan kimia. Semakin besar perbedaan antara nilai elektronegativitas, lebih besar momen dipol. Momen dipol mengukur polaritas molekul. Momen dipol molekul dihitung menggunakan persamaan berikut.
μ = σq.R
Di mana μ adalah momen dipol, q adalah besarnya muatan dan r adalah posisi pengisian daya. Di sini, μ dan r adalah vektor, yang merupakan jumlah yang memiliki arah serta besarnya.
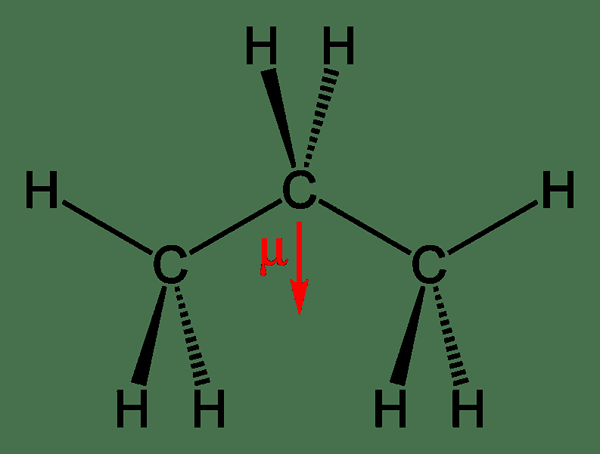
Gambar 2: Momen propana dipol
Namun kadang -kadang, istilah momen dipol digunakan untuk menyebutkan ukuran polaritas magnetik dari sistem tuduhan. Momen dipol magnetik menentukan torsi yang dialami magnet dalam medan magnet eksternal. (Torsi = momen; gaya rotasi).
Apa kesamaan momen ikatan dan momen dipol?
- Keduanya digunakan untuk mengukur polaritas (yang dibuat karena pemisahan muatan)
- Keduanya diukur dalam unit Debye (D) yang sama dengan Coulomb-meter (C M).
Apa perbedaan antara momen ikatan dan momen dipol?
Momen ikatan vs momen dipol | |
| Momen ikatan adalah pemisahan muatan listrik dalam ikatan kimia kovalen yang ada dalam senyawa kimia tertentu. | Momen dipol adalah pemisahan muatan listrik. |
| Pengukuran | |
| Momen ikatan mengukur polaritas ikatan kimia. | Momen dipol mengukur polaritas ikatan kimia atau molekul. |
| Kejadian | |
| Momen ikatan terjadi dalam ikatan kimia kovalen. | Momen dipol terjadi antara dua ion dalam ikatan ionik atau antara dua atom dalam ikatan kovalen dalam molekul. |
Ringkasan - momen ikatan vs momen dipol
Momen ikatan dan momen dipol adalah istilah terkait ketika datang ke polaritas ikatan kimia dalam molekul atau senyawa ionik. Perbedaan utama antara momen ikatan dan momen dipol adalah bahwa momen ikatan terjadi dalam ikatan kimia kovalen sedangkan momen dipol terjadi antara dua ion dalam ikatan ionik atau antara dua atom dalam ikatan kovalen.
Referensi:
1. “Momen dipol.”Kimia Libretexts, Libretexts, 16 Jan. 2018, tersedia di sini.
2. “Momen dipol ikatan.”Wikipedia, Wikimedia Foundation, 11 Mar. 2018, tersedia di sini.
Gambar milik:
1. “Polaritas Boron Trifluoride” oleh Emma Farmer (Serephine at English Wikipedia) - Dibuat dengan Adobe Photoshop oleh Emma Farmer (Domain Publik) melalui Commons Wikimedia
2. “Propana-Dipole-Moment-2D” oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia


