Perbedaan antara karbon 12 dan karbon 14
Itu perbedaan utama Antara karbon 12 dan karbon 14 adalah itu Karbon 12 memiliki 6 neutron dalam inti atomnya sedangkan karbon 14 memiliki 8 neutron.
Karbon 12 dan karbon 14 adalah isotop atom karbon. Atom karbon selalu memiliki 6 proton. Biasanya memiliki 6 neutron juga, itulah sebabnya kami menyebutnya karbon 12. Tetapi kadang -kadang ada 8 neutron, bukan 6, yaitu saat menjadi karbon 14. Dalam reaksi kimia, karbon 12 dan karbon 14 berperilaku dengan cara yang sama. Secara umum, karbon ditemukan di negara bagian C 12, tetapi kadang -kadang juga tersedia sebagai C 14.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu karbon 12
3. Apa itu karbon 14
4. Perbandingan berdampingan - karbon 12 vs karbon 14 dalam bentuk tabel
5. Ringkasan
Apa itu karbon 12?
Karbon 12 adalah isotop karbon alami yang paling umum, dari massa 12. Ini adalah dasar untuk skala unit massa atom yang diterima. Kelimpahan karbon ini sekitar 99%.

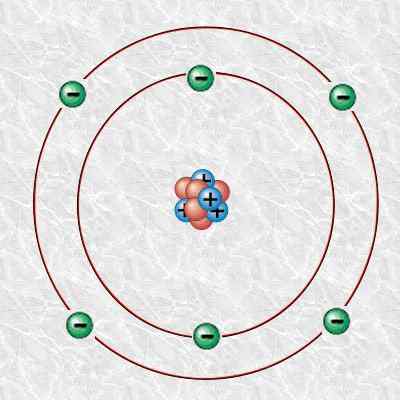
Gambar 1: Atom karbon
Selanjutnya, atom karbon ini terdiri dari 6 proton, 6 elektron, dan 6 neutron. Kita dapat menunjukkan karbon 12 secara ilmiah sebagai 12c. Massa isotopiknya adalah 12 u.
Apa itu karbon 14?
Karbon 14 adalah isotop karbon yang umum. Kami menyebutnya "radiokarbon" karena itu adalah isotop karbon radioaktif. Inti atom atom ini mengandung 6 proton, 6 elektron, dan 8 neutron. Massa isotopiknya adalah 14 u. Selain itu, karbon 14 sangat jarang, dan kelimpahannya sekitar 1 bagian per triliun.
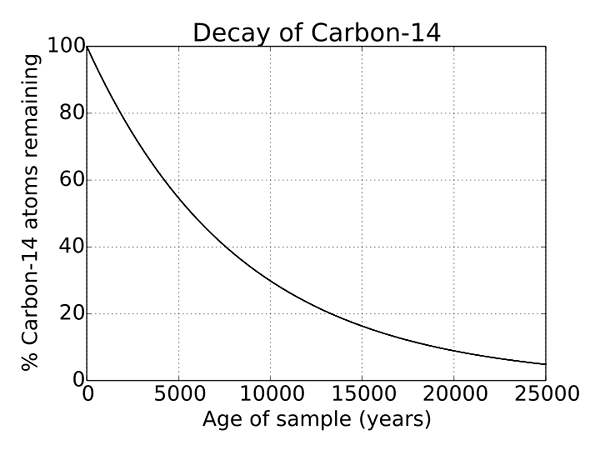
Gambar 2: Peluruhan radioaktif karbon 14
Karena C 14 adalah isotop atom karbon yang tidak stabil, ia mengalami peluruhan radioaktif. Dan, ini adalah proses yang terjadi untuk setiap isotop yang tidak stabil dan merupakan proses alami. Ini adalah sifat unik C 14 dan digunakan untuk penentuan objek yang berusia ribuan tahun dan digunakan secara luas dalam arkeologi. Waktu paruh C 14 adalah 5730 tahun.
Apa perbedaan antara karbon 12 dan karbon 14?
C 12 dan C 14 adalah isotop atom karbon. Perbedaan utama antara karbon 12 dan karbon 14 adalah bahwa karbon 12 memiliki 6 neutron dalam inti atomnya sedangkan karbon 14 memiliki 8 neutron. Karena berat proton dan neutron adalah sama, memiliki 8 neutron, C 14 lebih berat dari C 12. Selain itu, karena kedua C 12 dan C 14 memiliki jumlah proton yang sama, jumlah atomnya sama, tetapi bobot atomnya berbeda karena jumlah neutron yang berbeda. Jadi, ini adalah perbedaan yang signifikan antara C 12 dan C 14.
Selain itu, C 12 dan C 14 juga berperilaku berbeda dalam hal reaksi nuklir. Juga, perbedaan lebih lanjut antara C 12 dan C 14 adalah bahwa C 12 ditemukan secara berlimpah di kerak bumi sementara C 14 jarang. Selain itu, C 12 adalah isotop karbon yang stabil sedangkan C 14 adalah isotop yang tidak stabil dari atom karbon dan mengalami peluruhan radioaktif.

Ringkasan -Karbon 12 vs Karbon 14
Karbon 12 dan karbon 14 adalah isotop atom karbon. Atom karbon selalu memiliki 6 proton, tetapi jumlah neutron dapat bervariasi. Misalnya, karbon 12 dan karbon 14 adalah isotop karbon yang berbeda yang memiliki jumlah neutron yang berbeda. Oleh karena itu, perbedaan utama antara karbon 12 dan karbon 14 adalah bahwa karbon 12 memiliki 6 neutron dalam inti atomnya sedangkan karbon 14 memiliki 8 neutron.
Referensi:
1. "Karbon.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 Feb. 2019, tersedia di sini.
Gambar milik:
1. "Carbon-Atom" oleh Alejandro Porto-karya sendiri (CC BY-SA 3.0) Via Commons Wikimedia
2. “Peluruhan Radioaktif Karbon-14 SVG” oleh Exeterpaul-Karya Sendiri (CC BY-SA 3.0) Via Commons Wikimedia


