Perbedaan antara karbonat dan bikarbonat
Itu perbedaan utama antara karbonat dan bikarbonat adalah itu Ion karbonat memiliki muatan listrik -2 sedangkan, bikarbonat memiliki muatan listrik -1.
Tubuh manusia menghasilkan karbon dioksida sebagai produk sampingan dari metabolisme. Sebagian besar karbon dioksida ini larut dalam plasma darah dan hadir dalam bentuk bikarbonat. Sistem karbonat dan bikarbonat terutama bertanggung jawab untuk mempertahankan nilai pH darah kita, dan mereka bertindak sebagai penyangga dalam darah kita. Saat karbon dioksida larut dalam air, bikarbonat dan asam karbonat terbentuk, dan ada keseimbangan antara spesies ini.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu karbonat
3. Apa itu bikarbonat
4. Perbandingan berdampingan - karbonat vs bikarbonat dalam bentuk tabel
5. Ringkasan
Apa itu karbonat?
Karbonat adalah ion anorganik yang mengandung atom karbon dan tiga atom oksigen. Ini memiliki muatan divalen negatif (-2 muatan listrik). Ion karbonat memiliki geometri planar trigonal, dan berat molekulnya adalah 60 g mol-1.
Meskipun struktur ion karbonat Lewis memiliki satu ikatan rangkap karbon-oksigen dan dua ikatan tunggal karbon-oksigen, itu bukan struktur yang sebenarnya. Ion karbonat menunjukkan stabilisasi resonansi. Oleh karena itu, ia memiliki struktur hibrida dari semua struktur resonansi. Oleh karena itu, semua ikatan karbon-oksigen memiliki panjang yang sama, dan atom oksigen memiliki muatan negatif parsial (karenanya, semua atom oksigen serupa.).
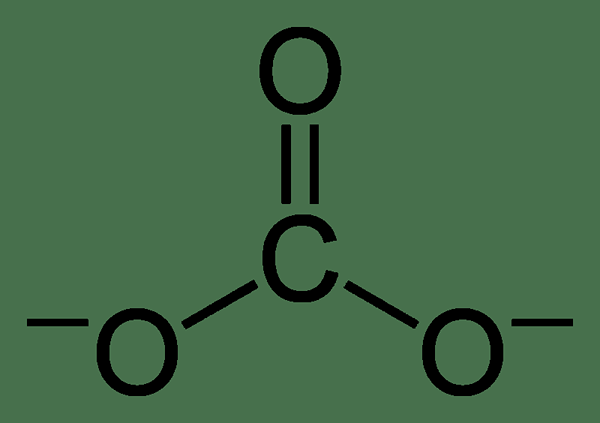
Gambar 01: Struktur kimia ion karbonat
Saat karbon dioksida atau bikarbonat larut dalam air, ion karbonat terbentuk. Dan, ion ini berada dalam keseimbangan dengan ion bikarbonat. Secara alami, ia bergabung dengan ion logam lain atau ion positif lainnya untuk membuat senyawa. Ada berbagai jenis batuan karbonat, seperti batu kapur (kalsium karbonat), dolomit (kalsium-magnesium karbonat), kalium (kalium karbonat) dll.
Selain itu, senyawa karbonat memainkan peran penting dalam siklus karbon. Seiring waktu, senyawa yang mengandung karbon dikonversi menjadi batuan sedimen saat mereka deposit untuk waktu yang lama. Kemudian, ketika batuan ini mengalami pelapukan, karbon dioksida dilepaskan kembali ke atmosfer. Demikian juga, saat memanaskan senyawa ini, mereka melepaskan karbon dioksida dengan mudah. Selanjutnya, senyawa karbonat adalah ionik, dan mereka tidak larut dalam air.
Apa itu bikarbonat?
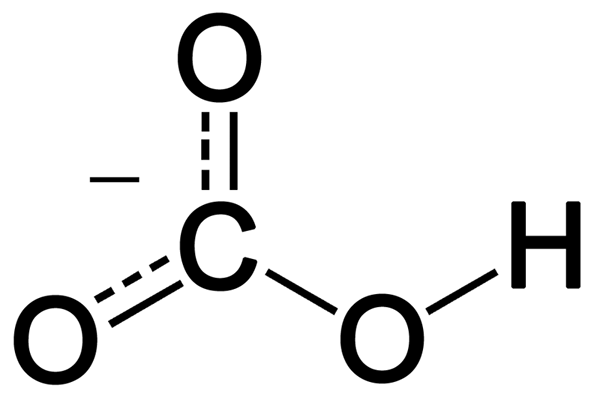
Bikarbonat adalah anion monovalen yang memiliki satu hidrogen, satu karbon dan tiga atom oksigen. Itu terbentuk dari deprotonasi asam karbonat. Itu memiliki geometri planar trigonal di sekitar atom karbon pusat. Ion bikarbonat memiliki berat molekul 61 g mol-1.

Gambar 02: Struktur resonansi ion bikarbonat
Selain itu, ion ini menunjukkan stabilisasi resonansi antara dua atom oksigen, yang tidak terhubung ke hidrogen. Di alam, bikarbonat adalah alkali, dan itu adalah asam konjugat ion karbonat dan basa konjugat asam karbonat. Selain itu, ion bermuatan positif dapat bergabung dengan oksigen bermuatan negatif dalam ion ini dan membentuk garam ionik. Garam bikarbonat yang paling umum adalah natrium bikarbonat, yang kami sebutkan sebagai baking powder dalam penggunaan sehari -hari. Selain itu, senyawa bikarbonat melepaskan karbon dioksida saat bereaksi dengan asam.
Apa perbedaan antara karbonat dan bikarbonat?
Karbonat dan bikarbonat adalah anion anorganik. Perbedaan utama antara karbonat dan bikarbonat adalah ion karbonat memiliki muatan listrik -2 sedangkan, bikarbonat memiliki muatan listrik -1. Selain itu, karena adanya atom hidrogen, massa molar ion karbonat adalah 60 g/mol sedangkan massa molar ion bikarbonat adalah 61 g/mol.
Perbedaan signifikan lainnya antara karbonat dan bikarbonat adalah bahwa, dalam kondisi yang sangat mendasar, akan ada lebih banyak ion karbonat, sedangkan ion bikarbonat akan lebih dalam solusi dasar yang lemah. Selain itu, kemampuan untuk larut dalam air juga berkontribusi pada perbedaan antara karbonat dan bikarbonat. Itu adalah; Senyawa dengan ion karbonat tidak larut dalam air pada suhu kamar dan tekanan atmosfer. Namun, banyak garam bikarbonat larut dalam air pada suhu kamar.
Di bawah ini adalah ringkasan perbedaan antara karbonat dan bikarbonat dalam bentuk tabel.
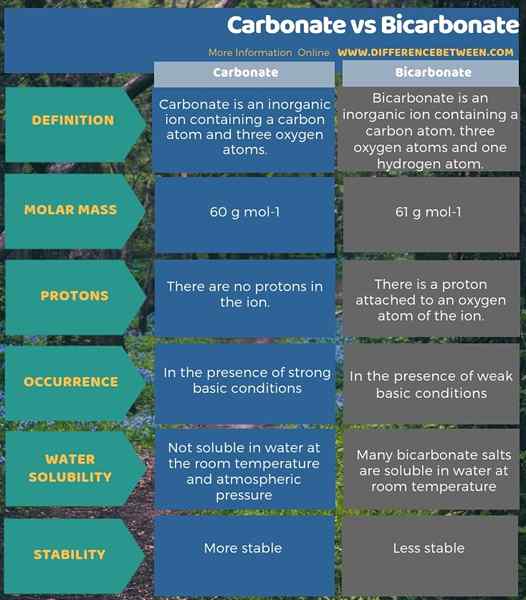
Ringkasan -karbonat vs bikarbonat
Baik karbonat dan bikarbonat adalah ion yang mengandung atom karbon dan oksigen. Namun, ion bikarbonat memiliki atom hidrogen juga. Oleh karena itu, atom hidrogen ini menyebabkan ion menjadi anion monovalen sedangkan karbonat adalah anion divalen. Singkatnya, perbedaan utama antara karbonat dan bikarbonat adalah bahwa ion karbonat memiliki muatan listrik -2 sedangkan, bikarbonat memiliki muatan listrik -1.
Referensi:
1. Britannica, editor Encyclopaedia. “Karbonat.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 Juli 1998. Tersedia disini
2. “Ion bikarbonat."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional. Tersedia disini
Gambar milik:
1."Karbonat-ion-Localized-2D" oleh Ben Mills-karya sendiri, (domain publik) melalui Commons Wikimedia
2.”Bikarbonat-Resonance” oleh Hellbus-karya sendiri, (CC BY-SA 3.0) Via Commons Wikimedia