Perbedaan antara asam karboksilat dan alkohol

Asam karboksilat vs alkohol
Asam karboksilat dan alkohol adalah molekul organik dengan gugus fungsi polar. Keduanya memiliki kemampuan untuk membuat ikatan hidrogen, yang mempengaruhi sifat fisiknya seperti titik didih.
Asam karboksilat
Asam karboksilat adalah senyawa organik yang memiliki gugus fungsional -cooh. Grup ini dikenal sebagai kelompok karboksil. Asam karboksilat memiliki formula umum sebagai berikut.
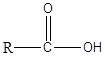
Dalam jenis asam karboksilat paling sederhana, kelompok R sama dengan H. Asam karboksilat ini dikenal sebagai asam format. Selanjutnya, kelompok R dapat berupa rantai karbon lurus, rantai bercabang, kelompok aromatik, dll. Asam asetat, asam heksanoat, dan asam benzoat adalah beberapa contoh untuk asam karboksilat. Dalam nomenklatur IUPAC, asam karboksilat dinamai dengan menjatuhkan final -e nama alkana yang sesuai dengan rantai terpanjang dalam asam dan dengan menambahkan -asam oat. Selalu, karbon karboksil ditetapkan nomor 1. Asam karboksilat adalah molekul polar. Karena kelompok -OH, mereka dapat membentuk ikatan hidrogen yang kuat satu sama lain dan dengan air. Akibatnya, asam karboksilat memiliki titik didih yang tinggi. Selanjutnya, asam karboksilat dengan bobot molekul yang lebih rendah dengan mudah larut dalam air. Namun, seiring dengan meningkatnya panjang rantai karbon, kelarutan berkurang. Asam karboksilat memiliki keasaman mulai dari PKA 4-5. Karena mereka asam, mereka bereaksi dengan mudah dengan NaOH dan Nahco3 Solusi untuk membentuk garam natrium yang larut. Asam karboksilat seperti asam asetat adalah asam lemah, dan mereka ada dalam kesetimbangan dengan basa konjugat dalam media berair. Namun, jika asam karboksilat memiliki gugus penarikan elektron seperti CL, F, mereka asam daripada asam yang tidak tersubstitusi.
Alkohol
Karakteristik keluarga alkohol adalah adanya kelompok fungsional -OH (kelompok hidroksil). Biasanya, grup -OH ini melekat pada SP3 karbon hibridisasi. Anggota keluarga yang paling sederhana adalah metil alkohol, yang juga dikenal sebagai metanol. Alkohol dapat diklasifikasikan menjadi tiga kelompok sebagai primer, sekunder dan tersier. Klasifikasi ini didasarkan pada tingkat substitusi karbon yang dilampirkan oleh kelompok hidroksil secara langsung. Jika karbon hanya memiliki satu karbon lain yang melekat padanya, karbon dikatakan sebagai karbon primer dan alkohol adalah alkohol primer. Jika karbon dengan gugus hidroksil melekat pada dua karbon lainnya, maka itu adalah alkohol sekunder dan seterusnya. Alkohol dinamai dengan akhiran -ol Menurut nomenklatur IUPAC. Pertama, rantai karbon kontinu terpanjang di mana gugus hidroksil secara langsung terpasang harus dipilih. Kemudian nama alkana yang sesuai diubah dengan menjatuhkan final e dan menambahkan sufiks ol.
Alkohol memiliki titik didih yang lebih tinggi daripada hidrokarbon atau eter yang sesuai. Alasan untuk ini adalah adanya interaksi antarmolekul antara molekul alkohol melalui ikatan hidrogen. Jika kelompok R kecil, alkohol dapat larut dengan air, tetapi karena kelompok R menjadi lebih besar, ia cenderung hidrofobik. Alkohol itu kutub. Obligasi C-O dan O-H berkontribusi pada polaritas molekul. Polarisasi ikatan O-H membuat hidrogen sebagian positif dan menjelaskan keasaman alkohol. Alkohol adalah asam lemah, dan keasamannya dekat dengan air. -Oh adalah kelompok yang buruk, karena oh- adalah basis yang kuat.
| Apa perbedaan antara Asam dan alkohol karboksilat? • Kelompok fungsional asam karboksilat adalah -cooh, dan dalam alkohol itu -oh. • Ketika kedua kelompok berada dalam satu molekul, prioritas diberikan pada asam karboksilat dalam nomenklatur. • Asam karboksilat memiliki keasaman yang lebih tinggi dibandingkan dengan alkohol yang sesuai. • Kelompok karboksilat dan kelompok -OH memberikan puncak karakteristik dalam spektrum IR dan NMR. |


