Perbedaan antara sifat koligatif elektrolit dan nonelektrolit
Perbedaan utama - Koligatif Sifat elektrolit vs nonelektrolit
Sifat koligatif adalah sifat fisik dari solusi yang tergantung pada jumlah zat terlarut tetapi tidak pada sifat zat terlarut. Ini berarti jumlah serupa dari zat terlarut yang sama sekali berbeda dapat mengubah sifat fisik ini dalam jumlah yang sama. Oleh karena itu, sifat koligatif tergantung pada rasio jumlah zat terlarut dan jumlah pelarut. Tiga sifat koligatif utama adalah penurunan tekanan uap, ketinggian titik didih dan depresi titik beku. Untuk rasio massa pelarut zat terlarut, semua sifat koligatif berbanding terbalik dengan massa molar zat terlarut. Elektrolit adalah zat yang dapat membentuk solusi yang mampu melakukan listrik melalui solusi ini. Solusi semacam itu dikenal sebagai solusi elektrolitik. Nonelektrolit adalah zat yang tidak mampu membentuk larutan elektrolitik. Kedua jenis ini (elektrolit dan nonelektrolit) memiliki sifat koligatif. Itu perbedaan utama Antara sifat koligatif elektrolit dan nonelektrolit adalah itu Efek elektrolit pada sifat koligatif sangat tinggi dibandingkan dengan nonelektrolit.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa sifat koligatif elektrolit
3. Apa sifat koligatif nonelektrolit
4. Perbandingan berdampingan - Sifat koligatif elektrolit vs nonelektrolit dalam bentuk tabel
5. Ringkasan
Apa sifat koligatif elektrolit?
Sifat koligatif elektrolit adalah sifat fisik dari larutan elektrolit yang bergantung pada jumlah zat terlarut terlepas dari sifat zat terlarut. Solut yang ada dalam larutan elektrolit adalah atom, molekul atau ion yang telah hilang atau didapat elektron untuk menjadi konduktif secara elektrik.
Ketika elektrolit dilarutkan dalam pelarut seperti air, elektrolit terpisah menjadi ion (atau spesies konduktif lainnya). Oleh karena itu, melarutkan satu mol elektrolit selalu menghasilkan dua atau lebih mol spesies konduktif. Oleh karena itu, sifat koligatif elektrolit sangat berubah ketika elektrolit dilarutkan dalam pelarut.
Misalnya, persamaan umum yang digunakan dalam menggambarkan titik beku dan perubahan titik didih adalah sebagai berikut,
ΔtB = KBm dan ΔtF = KFM
ΔtB adalah ketinggian titik mendidih, dan ΔtF adalah depresi titik beku. KB dan kF adalah titik ketinggian titik didih konstanta konstan dan titik beku konstan masing -masing. m adalah molaritas larutan. Untuk solusi elektrolitik, persamaan di atas dimodifikasi sebagai berikut,
ΔtB = IKBM dan ΔtF = IKFM
"I" adalah pengganda ion yang dikenal sebagai van't hoff factor. Faktor ini sama dengan jumlah mol ion yang diberikan oleh elektrolit. Oleh karena itu, faktor van't hoff dapat ditentukan dengan menemukan jumlah ion yang dilepaskan oleh elektrolit ketika dilarutkan dalam pelarut. Misalnya, nilai faktor van't hoff untuk NaCl adalah 2 dan di CACL2, itu 3.

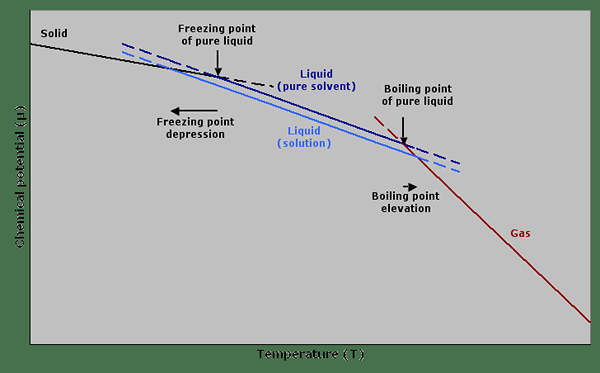
Gambar 01: Grafik yang menunjukkan potensi kimia terhadap suhu yang menggambarkan depresi titik beku dan ketinggian titik didih
Namun, nilai -nilai yang diberikan untuk sifat -sifat koligatif ini berbeda dari nilai -nilai yang diprediksi secara teoritis. Itu karena bisa ada interaksi terlarut dan pelarut yang mengurangi efek ion pada sifat -sifat tersebut.
Persamaan di atas selanjutnya dimodifikasi untuk digunakan untuk elektrolit yang lemah. Elektrolit yang lemah sebagian berdisosiasi menjadi ion, karenanya beberapa ion tidak mempengaruhi sifat koligatif. Tingkat disosiasi (α) dari elektrolit yang lemah dapat dihitung sebagai berikut,
α = (i-1)/(n-1) x 100
Di sini, n adalah jumlah maksimum ion yang terbentuk per molekul elektrolit lemah.
Apa sifat koligatif nonelektrolit?
Sifat koligatif nonelektrolit adalah sifat fisik dari solusi non-elektrolitik yang bergantung pada jumlah zat terlarut terlepas dari sifat zat terlarut. Non-elektrolit adalah zat yang tidak menciptakan solusi konduktif saat dilarutkan dalam pelarut. Misalnya, gula adalah nonelektrolit karena ketika gula dilarutkan dalam air, ia ada dalam bentuk molekuler (tidak terdisosiasi menjadi ion). Molekul gula ini tidak mampu melakukan arus listrik melalui larutan.
Jumlah zat terlarut yang ada dalam larutan non-elektrolitik kurang dibandingkan dengan larutan elektrolitik. Oleh karena itu, efek nonelektrolit pada sifat koligatif juga sangat rendah. Misalnya, tingkat penurunan tekanan uap dengan menambahkan NaCl lebih tinggi dibandingkan dengan penambahan gula ke larutan yang sama.
Apa perbedaan antara sifat koligatif elektrolit dan nonelektrolit?
Sifat koligatif elektrolit vs nonelektrolit | |
| Sifat koligatif elektrolit adalah sifat fisik dari larutan elektrolit yang bergantung pada jumlah zat terlarut terlepas dari sifat zat terlarut. | Sifat koligatif nonelektrolit adalah sifat fisik dari solusi non-elektrolitik yang bergantung pada jumlah zat terlarut terlepas dari sifat zat terlarut. |
| Zat terlarut | |
| Elektrolit memberikan lebih banyak zat terlarut untuk larutan melalui disosiasi; Oleh karena itu, sifat koligatif sangat berubah. | Nonelektrolit memberikan zat terlarut rendah untuk larutan karena tidak ada disosiasi; Oleh karena itu, sifat koligatif tidak banyak berubah. |
| Efek pada sifat koligatif | |
| Efek elektrolit pada sifat koligatif sangat tinggi dibandingkan dengan nonelektrolit. | Efek nonelektrolit pada sifat koligatif sangat rendah dibandingkan dengan elektrolit. |
Ringkasan - Koligatif Properti elektrolit vs non -elektrolit
Sifat koligatif adalah sifat fisik solusi yang tidak bergantung pada sifat zat terlarut tetapi jumlah zat terlarut. Perbedaan antara sifat koligatif elektrolit dan nonelektrolit adalah bahwa efek elektrolit pada sifat koligatif sangat tinggi dibandingkan dengan nonelektrolit.
Referensi:
1.“5.9: Sifat koligatif dari solusi elektrolit.”Kimia Libretexts, Libretexts, 21 Juli 2016. Tersedia disini
2.“Properti Koligatif.”Wikipedia, Wikimedia Foundation, 10 Mar. 2018. Tersedia disini
3.Britannica, editor Encyclopaedia. "Elektrolit.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 Juni 2017. Tersedia disini
Gambar milik:
1.'Depresi titik beku dan ketinggian titik didih' oleh karya tomas er - sendiri, (cc by -sa 3.0) Via Commons Wikimedia


