Perbedaan antara asam konjugat dan basa konjugat
Itu perbedaan utama antara asam konjugat dan basa konjugat adalah itu Konjugasi asam menyumbangkan proton, sedangkan basa konjugat menerima proton.
Pada tahun 1923, dua ilmuwan, Bronsted dan Lowry menyajikan teori tentang perilaku asam-basa. Menurut Bronsted - Lowry Theory, asam adalah donor proton, dan basa adalah akseptor proton. Oleh karena itu, molekul untuk berperilaku sebagai asam harus menghadapi akseptor proton. Di sisi lain, molekul untuk berperilaku sebagai basis yang harus dihadapi donor proton. Oleh karena itu, untuk reaksi asam-basa, baik donor proton dan akseptor harus ada di sana. Namun, air dapat bertindak sebagai asam dan basa. Saat air menerima proton, ia membentuk ion hidronium, dan ketika menyumbangkan proton, ia menghasilkan ion hidroksida.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam konjugat
3. Apa itu basis konjugat
4. Perbandingan berdampingan - asam konjugat vs basa konjugat dalam bentuk tabel
5. Ringkasan
Apa itu asam konjugat?
Asam konjugat adalah zat yang terbuat dari basa. Saat basa menerima proton dari molekul lain, itu membentuk asam konjugat. Asam konjugat dapat menghilangkan elektron dan kembali ke basa induk. Dengan demikian, asam konjugat memiliki sifat asam.

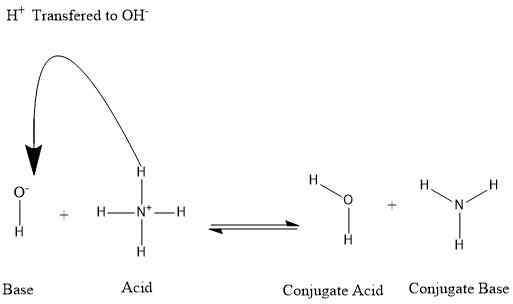
Gambar 01: Pembentukan asam konjugat dan basa konjugat
Misalnya, kita dapat mempertimbangkan situasi di mana amonia larut dalam air.
NH3+ H2O ⇌ nh4+ + OH-
Dalam contoh di atas, ion amonium adalah asam konjugat amonia. Demikian juga, saat mempertimbangkan reaksi mundur, air adalah asam konjugat basa hidroksida.
Apa itu basis konjugat?
Basa konjugat adalah zat yang terbentuk setelah asam memberikan proton ke basa. Tapi, ini dapat menerima proton lagi; Dengan demikian, ia memiliki karakteristik dasar. Akseptor proton potensial yang dibentuk dari asam induk adalah basa konjugat. Ketika basa konjugat menerima proton, itu terbalik ke asam induk lagi.
Selain itu, banyak pelarut dapat bertindak sebagai donor proton atau akseptor. Oleh karena itu, mereka dapat menginduksi perilaku asam atau basa dalam zat terlarut. Misalnya, ketika amonia larut dalam air, air bertindak sebagai asam dan memberikan proton terhadap amonia, dan dengan demikian, membentuk ion amonium. Sementara itu, molekul air dikonversi menjadi anion hidroksida. Di sini, dasar konjugat air adalah anion hidroksida. Dan dasar konjugat amonium adalah amonia.
Apa perbedaan antara asam konjugat dan basa konjugat?
Perbedaan utama antara asam konjugat dan basa konjugat adalah bahwa asam konjugat dapat menyumbangkan proton, sedangkan basa konjugat dapat menerima proton. Selain itu, asam konjugat terbentuk dari basa; Sebaliknya, basa konjugat terbentuk dari asam. Namun, asam konjugat dan basa yang terbentuk dalam reaksi spontan jauh lebih lemah daripada molekul induknya.

Ringkasan -asam konjugat vs basa konjugat
Asam konjugat dan basa konjugat adalah sepasang spesies kimia yang memiliki perilaku kimia yang berlawanan. Perbedaan utama antara asam konjugat dan basa konjugat adalah bahwa asam konjugat dapat menyumbangkan proton, sedangkan basa konjugat dapat menerima proton.
Referensi:
1. Libretexts. “11.12: pasangan asam-basa konjugat."Kimia Libretexts, National Science Foundation, 26 Nov. 2018. Tersedia disini
Gambar milik:
1."Reaksi Basis Konjugasi" oleh Schlenk (CC BY-SA 3.0) Via Commons Wikimedia


