Perbedaan antara konjugasi dan resonansi

Konjugasi vs resonansi
Konjugasi dan resonansi adalah dua fenomena penting dalam memahami perilaku molekul.
Apa itu konjugasi?
Dalam molekul ketika ada ikatan tunggal dan berganda yang ada, kami mengatakan bahwa sistem tersebut terkonjugasi. Misalnya, molekul benzena adalah sistem terkonjugasi. Dalam ikatan berganda, ada satu ikatan sigma dan satu atau dua kolam pi. Obligasi PI dibuat oleh orbital P yang tumpang tindih. Elektron dalam orbital P terletak tegak lurus terhadap bidang molekul. Jadi ketika ada ikatan PI dalam ikatan bergantian, semua elektron didelokalisasi di seluruh sistem terkonjugasi. Dengan kata lain, kami menyebutnya awan elektron. Karena elektron didelokalisasi, mereka milik semua atom dalam sistem terkonjugasi, tetapi tidak hanya untuk satu atom. Ini menurunkan energi keseluruhan sistem dan meningkatkan stabilitas. Tidak hanya, ikatan PI, tetapi juga pasangan elektron, radikal atau ion karbenium dapat mengambil bagian dalam menciptakan sistem terkonjugasi. Dalam hal ini, ada orbital P yang tidak terikat dengan dua elektron, satu elektron atau tidak ada elektron yang ada. Ada sistem terkonjugasi linier dan siklik. Beberapa hanya dibatasi untuk satu molekul. Ketika ada struktur polimer yang lebih besar, mungkin ada sistem terkonjugasi yang sangat besar. Kehadiran konjugasi memungkinkan molekul bertindak sebagai kromofor. Kromofor dapat menyerap cahaya; Oleh karena itu, senyawa akan diwarnai.
Apa itu resonansi?
Saat menulis struktur Lewis, kami hanya menunjukkan elektron valensi. Dengan memiliki atom berbagi atau mentransfer elektron, kami mencoba memberikan setiap atom konfigurasi elektronik gas mulia. Namun, dalam upaya ini, kami dapat memaksakan lokasi buatan pada elektron. Akibatnya, lebih dari satu struktur Lewis yang setara dapat ditulis untuk banyak molekul dan ion. Struktur yang ditulis dengan mengubah posisi elektron dikenal sebagai struktur resonansi. Ini adalah struktur yang hanya ada secara teori. Struktur resonansi menyatakan dua fakta tentang struktur.
• Tidak ada struktur resonansi yang akan menjadi representasi yang benar dari molekul yang sebenarnya. Dan tidak ada yang sepenuhnya akan menyerupai sifat kimia dan fisik dari molekul yang sebenarnya.
• Molekul aktual atau ion akan paling baik diwakili oleh hibrida dari semua struktur resonansi.
Struktur resonansi ditunjukkan dengan panah ↔. Berikut ini adalah struktur resonansi ion karbonat (CO32-).
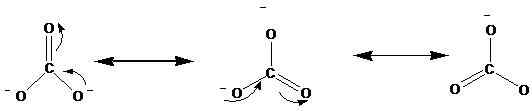
Studi x-ray telah menunjukkan bahwa molekul yang sebenarnya ada di antara resonansi ini. Menurut penelitian, semua ikatan karbon-oksigen memiliki panjang yang sama dalam ion karbonat. Namun, menurut struktur di atas, kita dapat melihat satu ikatan rangkap dan dua ikatan tunggal. Oleh karena itu, jika struktur resonansi ini terjadi secara terpisah, idealnya harus ada panjang ikatan yang berbeda dalam ion. Panjang ikatan yang sama menunjukkan bahwa tidak ada struktur ini yang benar -benar hadir di alam, lebih tepatnya hibrida dari ini ada.
| Apa perbedaan antara Konjugasi dan resonansi? • Resonansi dan konjugasi saling terkait. Jika ada konjugasi dalam molekul, kita dapat menggambar struktur resonansi dengan itu dengan mengganti ikatan PI. Karena elektron PI didelokalisasi di seluruh sistem terkonjugasi, semua struktur resonansi berlaku untuk molekul tersebut. • Resonansi memungkinkan sistem terkonjugasi untuk mendelokalisasi elektron. |


