Perbedaan antara cuprous dan cupric
Perbedaan utama -cuprous vs Cupric
Kation stabil yang dibentuk oleh tembaga, yang merupakan elemen blok D, adalah kation cuprous dan kation cupric. Ion cuprous dan cupric berbeda satu sama lain berdasarkan konfigurasi elektronik mereka. Itu perbedaan utama antara cuprous dan cupric adalah itu Cuprous adalah kation tembaga 1+ sedangkan cupric adalah kation tembaga +2.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu cuprous
3. Apa itu cupric
4. Kesamaan antara cuprous dan cupric
5. Perbandingan berdampingan - cuprous vs cupric dalam bentuk tabel
6. Ringkasan
Apa itu cuprous?
Nama Cuprous diberikan kepada +1 kation yang dibentuk oleh atom tembaga. Itu dilambangkan dengan cu+1. Konfigurasi elektron atom tembaga adalah [ar] 3D10 4s1. Saat kation cuprous terbentuk, konfigurasi elektron adalah [ar] 3d10 4s0. Oleh karena itu, kation cuprous terbentuk ketika satu elektron dikeluarkan dari atom tembaga. Karena kation cuprous dapat mengikat dengan hanya satu anion lain dengan keadaan oksidasi, kation cuprous dikenal sebagai a kation monovalen. Konfigurasi elektron kation cuprous sangat stabil. Jadi ada, banyak senyawa yang dibentuk oleh kation ini. Beberapa contoh ditunjukkan di bawah ini:
- Cuprous oksida (Cu2HAI)
- Cuprous iodide (CUI)
- Cuprous sulfide (Cu2S)
Energi hidrasi molekul atau ion adalah jumlah energi yang dilepaskan ketika satu mol dari senyawa itu hidrasi U8ndergo (disolusi dalam air).

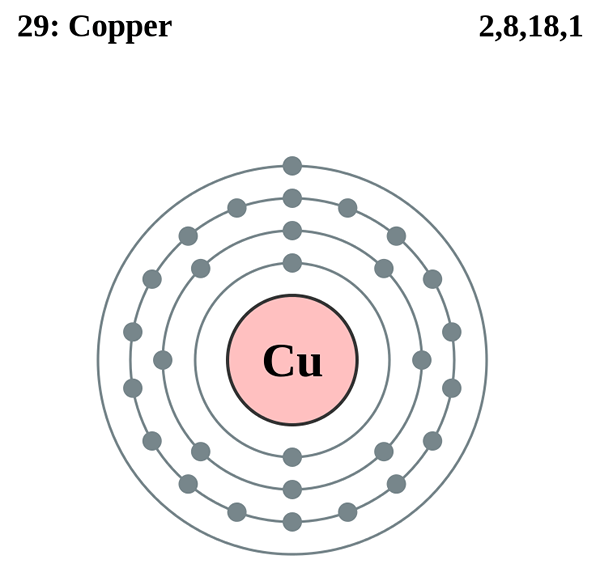
Gambar 01: Struktur atom tembaga
Ion cuprous memiliki energi hidrasi yang rendah dibandingkan dengan ion cupric karena d10 konfigurasi elektron dalam ion cuprous stabil dari d9 konfigurasi elektron dalam ion cupric.
Apa itu cupric?
Nama Cupric diberikan kepada kation +2 yang dibentuk oleh atom tembaga. Itu dilambangkan dengan cu2+. Konfigurasi elektron atom tembaga adalah [ar] 3D10 4s1. Ketika kation cupric terbentuk, konfigurasi elektron adalah [ar] 3d9 4s0. Kation cupric terbentuk ketika dua elektron dikeluarkan dari atom tembaga, memberikan atom 2+ muatan listrik. Kation cupric dapat mengikat dengan dua anion yang memiliki keadaan oksidasi -1 atau satu anion yang memiliki keadaan oksidasi -2. Oleh karena itu, kation cupric adalah kation divalen. Senyawa yang dibentuk dengan kation ini termasuk pengikut:
- Cupric Oxide (CuO)
- Cupric iodide (CUI)
- Cupric Sulfide (CUS)
Apa kesamaan antara cuprous dan cupric?
- Baik Cuprous dan Cupric adalah kation yang dibentuk dari hilangnya elektron dari atom tembaga.
- Keduanya adalah kation yang stabil.
- Keduanya memiliki muatan listrik yang positif.
- Keduanya memiliki massa atom yang sama (karena massa elektron dapat diabaikan).
Apa perbedaan antara cuprous dan cupric?
Cuprous vs Cupric | |
| Nama Cuprous diberikan kepada +1 kation yang dibentuk oleh atom tembaga. | Nama Cupric diberikan kepada kation +2 yang dibentuk oleh atom tembaga. |
| Kategori | |
| Ion cuprous adalah kation monovalen. | Ion cupric adalah kation divalen. |
| Konfigurasi elektron | |
| Konfigurasi elektron ion cuprous adalah [ar] 3d10 4s0. | Konfigurasi elektron ion cupric adalah [ar] 3d9 4s0. |
| Elektron hilang untuk membentuk atom tembaga | |
| Ion cuprous terbentuk saat satu elektron hilang dari atom tembaga. | Ion cupric terbentuk saat dua elektron hilang dari atom tembaga. |
| Stabilitas | |
| Stabilitas ion cuprous tinggi karena D10 konfigurasi elektron. | Stabilitas ion cupric rendah karena D9 konfigurasi elektron. |
| Denotasi | |
| Ion cuprous dilambangkan dengan Cu+1. | Ion cupric dilambangkan dengan Cu2+. |
| Muatan listrik | |
| Ion cuprous memiliki +1 muatan listrik. | Ion cupric memiliki +2 muatan listrik. |
| Energi hidrasi | |
| Energi hidrasi ion cuprous rendah dibandingkan dengan ion cupric. | Energi hidrasi ion cupric tinggi bila dibandingkan dengan ion cuprous. |
Ringkasan -Cuprous vs Cupric
Ion cuprous dan ion cupric adalah kation yang dibentuk dari atom tembaga karena hilangnya elektron. Perbedaan antara cuprous dan cupric adalah bahwa cuprous adalah kation tembaga 1+ sedangkan cupric adalah kation tembaga +2.
Referensi:
1. "Tembaga.”Wikipedia, Wikimedia Foundation, 3 Apr. 2018. Tersedia disini
2. “Kation Cupric."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional. Tersedia disini
Gambar milik:
1.'Electron Shell 029 Copper' (CC BY-SA 2.0 uk) via commons wikimedia


