Perbedaan antara CUSO4 dan CUSO4 5H2O

Itu perbedaan utama di antara CUSO4 dan CUSO4 5H2O adalah bahwa CUSO4 adalah amorf, sedangkan CUSO4 5H2O adalah kristal.
CUSO4 adalah formula kimia tembaga (II) sulfat, sedangkan CUSO4 5H2O adalah bentuk terhidrasi dari tembaga (II) sulfat. Istilah terhidrasi menunjukkan bahwa senyawa ini memiliki satu atau lebih molekul air yang terkait dengannya. Oleh karena itu, CUSO4 adalah nama yang biasa untuk bentuk anhidrat.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu CUSO4
3. Apa itu CUSO4 5H2O
4. Perbandingan berdampingan - CUSO4 vs CUSO4 5H2O dalam bentuk tabel
5. Ringkasan
Apa itu CUSO4?
CUSO4 adalah tembaga (II) sulfat yang memiliki logam tembaga dalam keadaan oksidasi +2. Itu adalah senyawa anorganik yang tidak memiliki molekul air yang terkait dengannya. Oleh karena itu, kami menyebutnya bentuk anhidrat tembaga sulfat. Selain itu, senyawa anhidrat ini terjadi sebagai bubuk putih.
Produksi industri tembaga sulfat melibatkan mengobati logam tembaga dengan asam sulfat dalam bentuk panas dan pekat. Juga, dimungkinkan untuk menghasilkan senyawa ini menggunakan oksida tembaga juga. Di sini, itu dilakukan dengan mengobati oksida tembaga dengan asam sulfat encer. Selain itu, perlahan-lahan mencelupkan bijih tembaga bermutu rendah di udara adalah metode produksi lain. Dimungkinkan untuk menggunakan bakteri untuk mengkatalisasi proses ini.

Gambar 02: Tembaga sulfat anhidrat
Saat mempertimbangkan sifat kimia senyawa ini, massa molar adalah 159.6 g/mol. Itu muncul dalam warna abu-abu putih. Kepadatannya adalah 3.60 g/cm3. Saat mempertimbangkan titik leleh tembaga sulfat, itu adalah 110 ° C, dan setelah pemanasan lebih lanjut, senyawa terurai.
Apa itu CUSO4 5H2O?
CUSO4 5H2O adalah tembaga (ii) sulfat pentahydrate. Ini memiliki lima molekul air yang terkait dengan molekul tembaga sulfat. Itu muncul sebagai warna biru cerah solid. Selain itu, ini adalah bentuk terhidrasi yang paling umum dari tembaga sulfat. Selanjutnya, beberapa nama umum untuk senyawa ini adalah vitriol biru, bluestone, vitriol tembaga, vitriol Romawi, dll.

Gambar 02: Penampilan tembaga sulfat pentahydrate
Selain itu, senyawa ini secara eksotermal larut dalam air. Kemudian, ia membentuk kompleks aqua yang mengandung satu molekul CUSO4 dalam hubungan dengan enam molekul air, dan kompleks ini memiliki geometri molekul oktahedral. Massa molar adalah 249.65 g/mol. Saat mempertimbangkan titik leleh, setelah pemanasan di atas 560 ° C, senyawa terurai. Itu berarti; senyawa terurai sebelum meleleh. Di sana, senyawa ini menghilangkan dua molekul air pada 63 ° C dan dua lagi pada 109 ° C. Selain itu, molekul air terakhir dilepaskan pada 200 ° C.
Apa perbedaan antara CUSO4 dan CUSO4 5H2O?
CUSO4 adalah tembaga (II) sulfat yang memiliki logam tembaga dalam keadaan oksidasi +2. CUSO4 5H2O adalah tembaga (ii) sulfat pentahydrate. Perbedaan utama antara CUSO4 dan CUSO4 5H2O adalah bahwa CUSO4 adalah amorf, sedangkan CUSO4 5H2O adalah kristal. Lebih lanjut, tembaga sulfat adalah anhidrat sedangkan tembaga sulfat pentahydrate adalah bentuk yang terhidrasi.
Selain itu, perbedaan lebih lanjut antara CUSO4 dan CUSO4 5H2O adalah titik leleh mereka; Titik leleh CUSO4 adalah 110 ° C, dan setelah pemanasan lebih lanjut, senyawa terurai, sedangkan senyawa CUSO4 5H2O terurai sebelum melelehkan.
Di bawah infografis menunjukkan lebih banyak informasi mengenai perbedaan antara CUSO4 dan CUSO4 5H2O.
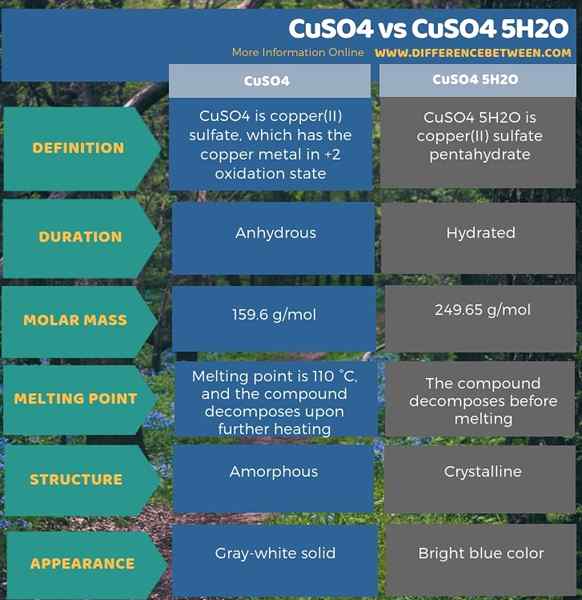
Ringkasan -CUSO4 vs CUSO4 5H2O
CUSO4 adalah tembaga (II) sulfat yang memiliki logam tembaga dalam keadaan oksidasi +2. CUSO4 5H2O adalah tembaga (ii) sulfat pentahydrate. Singkatnya, perbedaan utama antara CUSO4 dan CUSO4 5H2O adalah bahwa CUSO4 adalah amorf, sedangkan CUSO4 5H2O adalah kristal.
Referensi:
1. “Tembaga sulfat pentahydrate."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional, tersedia di sini.
Gambar milik:
1. "Copper Sulfate" oleh Stephanb - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia
2. "Tembaga sulfat anhidrat" oleh w. Oelen - (CC BY -SA 3.0) Via Commons Wikimedia


