Perbedaan antara hukum gas ideal dan hukum gas nyata
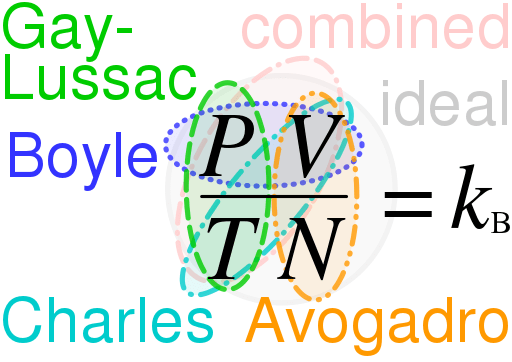
Itu perbedaan utama antara hukum gas ideal dan hukum gas nyata adalah itu Hukum gas ideal menggambarkan perilaku gas teoretis, sedangkan hukum gas nyata menggambarkan perilaku gas yang benar -benar terjadi di alam semesta.
Gas ideal adalah gas teoretis yang partikel gas yang bergerak secara acak memiliki tabrakan yang benar -benar elastis dan tidak ada interaksi lain di antara mereka. Menurut definisi ini, kita dapat memahami bahwa gas ideal ini tidak dapat terjadi di alam karena pada dasarnya ada interaksi antara partikel gas untuk gas apa pun yang kita tahu. Faktanya, gas yang kita tahu adalah gas asli.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Hukum Gas Ideal
3. Apa itu Hukum Gas Nyata
4. Perbandingan berdampingan - Hukum Gas Ideal vs Hukum Gas Nyata dalam bentuk tabel
5. Ringkasan
Apa hukum gas yang ideal?
Hukum Gas Ideal adalah persamaan yang menggambarkan perilaku gas ideal. Gas ideal hipotetis, dan gas -gas ini hanya terjadi dalam teori. Oleh karena itu, menggunakan hukum gas yang ideal, kita dapat memahami dan memperkirakan perilaku banyak gas nyata yang kita tahu. Namun, ia memiliki beberapa keterbatasan. Juga, undang -undang ini adalah kombinasi dari beberapa undang -undang lain:
- hukum Boyle
- Hukum Charles
- Hukum Avogadro
- Hukum Gay-Lussac
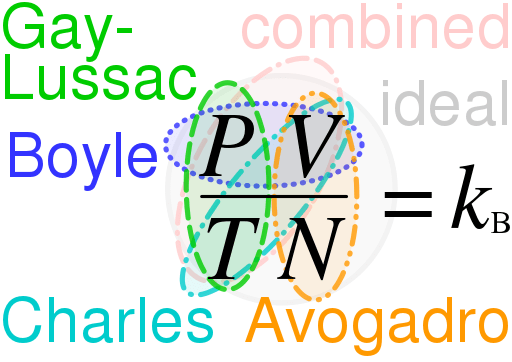
Perhitungan
Pada dasarnya, kita dapat memberikan hukum gas yang ideal sebagai berikut;
PV = NRT
Di mana, p adalah tekanan, v adalah volume dan t adalah suhu gas ideal. Di sini, "n" adalah jumlah mol dari gas ideal dan "r" adalah konstan - kami menyebutnya Konstanta Gas Ideal. Ini memiliki nilai universal; Nilai R adalah sama untuk gas apa pun, dan itu 8.314 J/(k · mol).
Selain itu, kita dapat memperoleh turunan yang berbeda dari undang -undang ini; bentuk molar, bentuk gabungan, dll. Misalnya, karena "n" adalah jumlah tahi lalat, kami dapat memberikannya menggunakan berat molekul gas. Derivasi adalah sebagai berikut.
n = m/m
di mana, n adalah jumlah mol gas, m adalah massa gas dan m adalah berat molekul gas. Dengan menggunakan persamaan di atas,
PV = NRT
Pv = (m/m) rt
Jika kita ingin mendapatkan kepadatan gas, kita dapat menggunakan persamaan di atas sebagai berikut;
P = (m/vm) rt
P = ρrt/m
Selain itu, jika kita ingin mendapatkan hukum gas gabungan dari hukum gas yang ideal, kita dapat memperolehnya sebagai berikut; Untuk dua gas "1" dan "2", tekanan, volume dan suhu adalah P1,V1,T1 dan p2, V2 dan T2. Kemudian untuk dua gas, kita dapat menulis dua persamaan sebagai;
P1V1 = Nrt1… (1)
P2V2 = Nrt2 … (2)
Dengan membagi persamaan (1) dari persamaan (2), kami dapatkan,
(P1V1)/(P2V2) = T1/ T2
Kita dapat mengatur ulang persamaan ini sebagai berikut;
P1V1/ T1 = P2V2/ T2
Apa itu Hukum Gas Nyata?
Hukum gas nyata, juga disebut Hukum Van der Waals, berasal dari hukum gas ideal untuk menggambarkan perilaku gas nyata. Karena gas nyata tidak dapat berperilaku idealnya, hukum gas nyata telah membuat perubahan pada tekanan dan komponen volume dalam hukum gas yang ideal. Dengan demikian, kita dapat memperoleh volume dan tekanan sebagai berikut:
Volume gas asli = (vM - B)
Tekanan gas nyata = (p + a n2/V2)
Kemudian, kita bisa mendapatkan hukum gas nyata dengan menerapkan komponen yang dimodifikasi ini pada hukum gas ideal sebagai berikut:
(P + a n2/V2) (VM - b) = NRT
Dimana, vM adalah volume molar gas, r adalah konstanta gas universal, t adalah suhu gas asli, p adalah tekanan.
Apa perbedaan antara hukum gas ideal dan hukum gas nyata?
Hukum Gas Ideal adalah persamaan yang menggambarkan perilaku gas ideal. Hukum gas nyata berasal dari hukum gas ideal yang sesuai dengan perilaku gas nyata. Jadi, perbedaan utama antara hukum gas ideal dan hukum gas nyata adalah bahwa hukum gas ideal menggambarkan perilaku gas teoretis, sedangkan hukum gas nyata menggambarkan perilaku gas yang benar -benar terjadi di alam semesta.
Selain itu, kita dapat memperoleh hukum gas ideal dari persamaan PV = NRT, dan hukum gas asli dari persamaan (p + a n2/V2) (VM - b) = NRT.
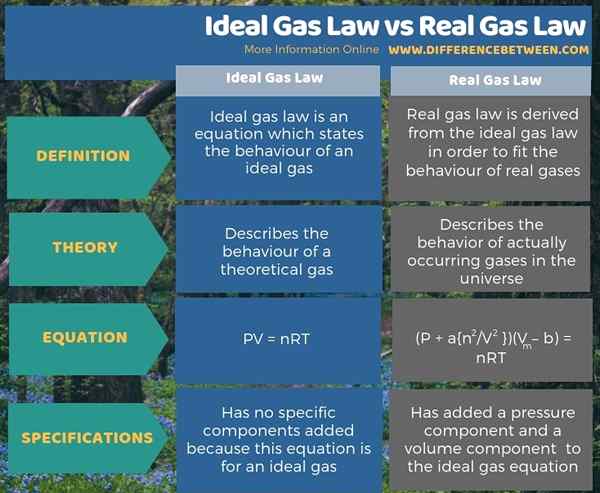
Ringkasan -Hukum Gas Ideal vs Hukum Gas Nyata
Singkatnya, gas ideal adalah zat hipotetis yang memiliki tabrakan yang benar -benar elastis antara partikel gas, properti yang sebagian besar gas nyata yang tidak kita ketahui tidak menunjukkan. Perbedaan utama antara hukum gas ideal dan hukum gas nyata adalah bahwa hukum gas ideal menggambarkan perilaku gas teoretis, sedangkan hukum gas nyata menggambarkan perilaku gas yang benar -benar terjadi di alam semesta.
Referensi:
1. Hukum Gas Ideal, Hiperfisika. Georgia State University, tersedia di sini.
Gambar milik:
1. “Hubungan Hukum Gas Ideal” oleh CMGLEE - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. "Hukum Gas Ideal" oleh Blyumj - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


