Perbedaan antara disproporsional dan redoks

Itu perbedaan utama Antara disproporsional dan redoks adalah itu Dalam reaksi disproporsional, reaktan yang sama mengalami oksidasi dan reduksi. Tetapi, dalam reaksi redoks, dua reaktan yang berbeda biasanya mengalami oksidasi dan reduksi.
Lebih lanjut, disproporsional adalah reaksi kimia di mana molekul diubah menjadi dua atau lebih produk yang berbeda sementara reaksi redoks adalah jenis reaksi kimia di mana oksidasi dan pengurangan setengah reaksi terjadi secara bersamaan. Di atas segalanya, disproporsional adalah jenis reaksi redoks karena ada dua reaksi oksidasi dan reduksi simultan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu disproporsional
3. Apa itu redoks
4. Perbandingan berdampingan - Disproporsional vs Redoks dalam bentuk tabel
5. Ringkasan
Apa itu disproporsional?
Disproporsional adalah reaksi kimia di mana molekul diubah menjadi dua atau lebih produk yang berbeda. Pada dasarnya, ini adalah jenis reaksi redoks di mana molekul yang sama mengalami oksidasi dan reduksi. Selanjutnya, kebalikan dari reaksi ini disebut komproporsional. Bentuk umum dari reaksi ini adalah sebagai berikut:
2a ⟶ a ' +a "
Selain itu, beberapa contoh umum untuk jenis reaksi ini adalah sebagai berikut
- Konversi hidrogen peroksida menjadi air dan oksigen
2h2HAI2 ⟶ h2O +o2
- Disproporsionasi Merkurius (I) Klorida
HG2Cl2 → HG + HGCL2
- Disproporsional asam fosfat ke dalam asam fosfat dan fosfin
4 h3PO3 → 3 H3PO4 + Ph3
- Disproporsionasi bromin fluoride memberikan bromin trifluorida dan bromin
3 BRF → BRF3 + Br2
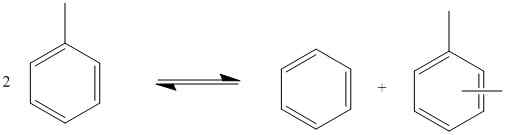
Gambar 01: Disproporsional Toluena
Apa itu redoks?
Reaksi redoks adalah jenis reaksi kimia di mana oksidasi dan reduksi setengah reaksi terjadi secara bersamaan. Selain itu, dalam reaksi ini, kami menganggap oksidasi dan pengurangan sebagai proses pelengkap. Di sini, oksidasi adalah hilangnya elektron atau peningkatan keadaan oksidasi sementara reduksi adalah gain elektron atau penurunan keadaan oksidasi.

Gambar 02: Karat
Selain itu, laju reaksi redoks dapat bervariasi dari proses yang sangat lambat seperti berkarat ke proses yang cepat seperti pembakaran bahan bakar.
Apa perbedaan antara disproporsional dan redoks?
Perbedaan utama antara disproporsional dan redoks adalah bahwa dalam reaksi disproporsionasi reaktan yang sama mengalami oksidasi dan reduksi, sedangkan, dalam reaksi redoks, dua reaktan yang berbeda biasanya mengalami oksidasi dan reduksi. Mempertimbangkan beberapa contoh, disproporsional termasuk disproporsionalasi merkuri (i) klorida untuk membentuk merkuri dan merkuri (ii) klorida, disproporsionalasi bromin fluoride untuk membentuk trifluorida dan bromin bromin, dll, dll. Sedangkan berkarat, pembakaran, pembakaran bahan bakar, dll. adalah contoh untuk reaksi redoks.
Infografis di bawah ini merangkum perbedaan antara disproporsional dan redoks.

Ringkasan -Disproporsional vs Redoks
Disproporsional adalah reaksi kimia di mana molekul diubah menjadi dua atau lebih produk yang berbeda sementara reaksi redoks adalah jenis reaksi kimia di mana oksidasi dan pengurangan setengah reaksi terjadi secara bersamaan. Perbedaan utama antara disproporsional dan redoks adalah bahwa dalam reaksi disproporsionasi reaktan yang sama mengalami oksidasi dan reduksi, sedangkan dalam reaksi redoks, biasanya, dua reaktan yang berbeda mengalami oksidasi dan reduksi.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Disproporsional dalam Kimia."Thoughtco, Aug. 6, 2019, tersedia di sini.
Gambar milik:
1. “Disproporsional Toluene” oleh Warrenjlange - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. “Rust Screw” oleh pengguna: Paulnasca - pekerjaan sendiri (CC dengan 2.0) Via Commons Wikimedia


