Perbedaan antara elektropositif dan elektronegatif
Itu perbedaan utama antara elektropositif dan elektronegatif adalah itu Elektropositif mengacu pada kemampuan untuk kehilangan elektron, membentuk kation, sedangkan elektronegatif mengacu pada kemampuan untuk mendapatkan elektron, membentuk anion.
Istilah elektropositif dan elektronegatif datang dengan daya tarik atau tolakan elemen kimia terhadap elektron. Kami dapat mengkategorikan elemen kimia sesuai dengan karakteristik ini; Entah mereka kehilangan atau mendapatkan elektron selama reaksi kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa yang elektropositif
3. Apa itu elektronegatif
4. Perbandingan berdampingan - elektropositif vs elektronegatif dalam bentuk tabel
5. Ringkasan
Apa yang elektropositif?
Elektropositif berarti elemen kimia cenderung kehilangan elektron. Kehilangan elektron membentuk kation atau ion bermuatan positif dalam reaksi kimia. Ini adalah ukuran kemampuan elemen untuk menyumbangkan elektron. Elemen cenderung kehilangan elektron mereka untuk mendapatkan konfigurasi elektron gas mulia.
Biasanya, semua logam dianggap sebagai elemen kimia elektropositif karena mereka memiliki elektron yang mudah dilepas di orbital terluarnya. Di antara mereka, logam alkali (elemen kimia kelompok 1) adalah elemen yang paling elektropositif. Secara teoritis, francium adalah elemen kimia yang paling elektropositif, meskipun tidak stabil di alam. Meskipun hidrogen berada dalam kelompok1 dari tabel periodik, ia dapat kehilangan atau mendapatkan elektron; Oleh karena itu, kami dapat mengkategorikannya di bawah elemen elektropositif dan elektronegatif.
Apa itu elektronegatif?
Elektronegatif mengacu pada kemampuan elemen kimia untuk mendapatkan elektron. Mendapatkan elektron dari anion bentuk luar; Anion adalah spesies kimia bermuatan negatif. Elektronegativitas adalah kebalikan dari elektropositif. Simbol untuk fenomena ini adalah χ. Istilah ini dapat merujuk pada daya tarik pasangan elektron bersama atau kepadatan elektron terhadap dirinya sendiri. Ada dua faktor utama yang mempengaruhi elektronegativitas elemen kimia: jumlah atom dan jarak antara nukleus dan elektron valensi.

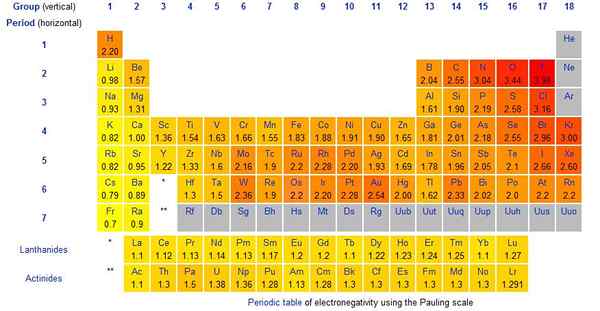
Gambar 01: Nilai Skala Pauling untuk Elemen Kimia
Skala Pauling adalah metode yang kami gunakan untuk memberikan nilai pada elektronegativitas elemen kimia. Skala diusulkan oleh Linus Pauling. Itu adalah kuantitas tanpa dimensi. Selain itu, ini adalah skala relatif yang mempertimbangkan elektronegativitas berkisar dari 0.79 hingga 3.98. Elektronegativitas hidrogen adalah 2.20. Elemen paling elektronegatif adalah fluor, dan nilai skala Pauling adalah 3.98 (biasanya kita mengambilnya sebagai 4). Biasanya, semua halogen (elemen kelompok 7) sangat elektronegatif.
Apa perbedaan antara elektropositif dan elektronegatif?
Perbedaan utama antara elektropositif dan elektronegatif adalah bahwa istilah elektropositif mengacu pada kemampuan untuk kehilangan elektron, membentuk kation, sedangkan elektronegatif mengacu pada kemampuan untuk mendapatkan elektron, membentuk anion. Selain itu, ketika mempertimbangkan elemen kimia di bagian atas daftar, dalam daftar elemen elektropositif, elemen yang paling elektropositif adalah francium sedangkan di antara elemen elektronegatif, elemen yang paling elektronegatif adalah fluorin.
Skala Pauling adalah skala yang kami gunakan untuk memberikan nilai pada setiap elemen elektropositif dan elektronegatif. Namun, skala ini memberikan elektronegativitas suatu elemen; Oleh karena itu, kita dapat menentukan bahwa nilai elektronegativitas yang sangat rendah menunjukkan bahwa elemen lebih elektropositif.
Di bawah infografis merangkum perbedaan antara elektropositif dan elektronegatif.

Ringkasan -elektropositif vs elektronegatif
Istilah elektropositif dan elektronegatif menggambarkan daya tarik atau tolakan elemen kimia terhadap elektron. Perbedaan utama antara elektropositif dan elektronegatif adalah bahwa istilah elektropositif mengacu pada kemampuan untuk kehilangan elektron yang membentuk kation, sedangkan elektronegatif mengacu pada kemampuan untuk mendapatkan elektron yang membentuk anion.
Skala Pauling adalah skala yang kami gunakan untuk memberikan nilai pada setiap elemen elektropositif dan elektronegatif. Skala tersebut memberikan elektronegativitas suatu elemen; Oleh karena itu, kita dapat menentukan bahwa nilai elektronegativitas yang sangat rendah menunjukkan bahwa elemen lebih elektropositif.
Referensi:
1.“Elektronegativitas.”Wikipedia, Wikimedia Foundation, 13 September. 2019, tersedia di sini.
2. “Mengapa logam disebut elemen elektropositif ynosb3ss -chemistry.“Topperlearning, tersedia di sini.
Gambar milik:
1. "Electronegative" oleh Adblocker - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


