Perbedaan antara reaksi dasar dan non -dasar
Itu perbedaan utama Antara reaksi dasar dan non -dasar adalah bahwa Reaksi dasar memiliki satu langkah, sedangkan reaksi non-elemen memiliki beberapa langkah.
Kita dapat mengklasifikasikan reaksi kimia dengan cara yang berbeda tergantung pada faktor yang berbeda, seperti reaktan reaksi, produk reaksi, katalis, urutan reaksi, laju reaksi, dll. Dari jumlah tersebut, reaksi dasar dan non-elemen dibagi berdasarkan jumlah sub-langkah reaksi kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu reaksi dasar
3. Apa reaksi non -dasar
4. Perbandingan berdampingan - reaksi dasar vs non -dasar dalam bentuk tabel
5. Ringkasan
Apa itu reaksi dasar?
Reaksi dasar adalah reaksi kimia yang mencakup sub-langkah tunggal. Dalam reaksi ini, satu spesies kimia mengalami perubahan langsung untuk memberikan produk akhir dalam satu langkah. Di sini, keadaan transisi tunggal diamati. Secara eksperimental, jika kita tidak dapat mendeteksi produk perantara selama reaksi kimia, kita dapat mengkategorikan reaksi itu sebagai reaksi dasar.

Gambar 01: Reaksi dasar dalam sintesis organik
Selain itu, ada beberapa jenis reaksi dasar. Mereka adalah sebagai berikut:
Reaksi unimolekul
Dalam hal ini, reaktan tunggal mengalami reaksi seperti dekomposisi untuk memberikan produk akhir. Contoh reaksi unimolekul termasuk isomerisasi CIS-Trans, pembukaan cincin, racemization, peluruhan radioaktif, dll.
Reaksi bimolekul
Sementara itu, dalam reaksi bimolekul, dua partikel mengalami tabrakan untuk memberikan produk (s). Ini adalah reaksi orde kedua karena laju reaksi tergantung pada kedua reaktan. Contohnya termasuk reaksi substitusi nukleofilik.
Reaksi trimolekul
Demikian pula, dalam reaksi trimolekul, tiga partikel mengalami tabrakan pada saat yang sama untuk memberikan produk (s). Namun, tipe ini jarang terjadi karena sulit bagi tiga reaktan untuk bertabrakan pada saat yang sama.
Apa reaksi non -dasar?
Reaksi non-elemen adalah reaksi kimia yang mencakup beberapa sub-langkah. Itu berarti; Reaksi -reaksi ini memiliki serangkaian langkah dan keadaan transisi yang berbeda dengan intermediet yang berbeda juga. Oleh karena itu, reaksi ini sangat kompleks.
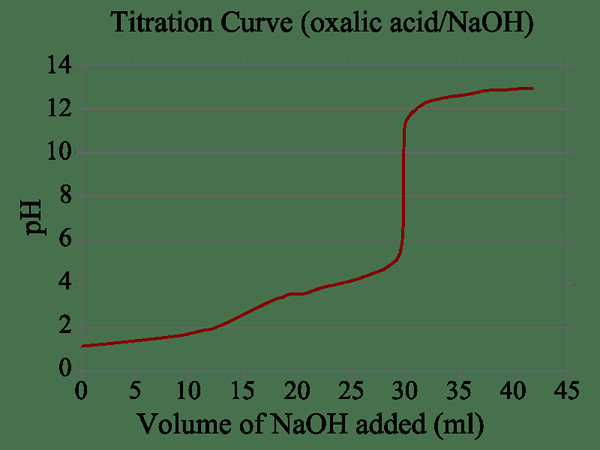
Gambar 02: Grafik untuk reaksi dua langkah
Selain itu, tidak seperti dalam reaksi dasar, urutan reaksi tidak setuju dengan koefisien stoikiometrik dari reaksi. Selain itu, urutan reaksi ini bisa berupa bilangan bulat atau pecahan.
Apa perbedaan antara reaksi dasar dan non -dasar?
Perbedaan antara reaksi dasar dan non-dasar tergantung pada jumlah sub-langkah reaksi kimia. Oleh karena itu, perbedaan utama antara reaksi dasar dan non-dasar adalah bahwa reaksi dasar memiliki satu langkah sementara reaksi non-elemen memiliki beberapa langkah. Oleh karena itu, dalam reaksi dasar, ada keadaan transisi tunggal, dan tidak ada perantara yang dapat dideteksi yang dihasilkan selama reaksi. Namun, dalam reaksi non-elemen, ada serangkaian keadaan transisi dengan beberapa perantara yang dapat kami deteksi dengan mudah.
Selain itu, reaksi dasar sederhana, sedangkan reaksi non-elemen kompleks. Dalam reaksi dasar, urutan reaksi sama dengan koefisien stoikiometrik dari reaksi sementara, dalam reaksi non-elemen, urutan reaksi mungkin atau mungkin tidak sama dengan koefisien stoikiometrik dari reaksi tersebut.
Infografis di bawah ini menunjukkan detail lebih lanjut tentang perbedaan antara reaksi dasar dan non -dasar.
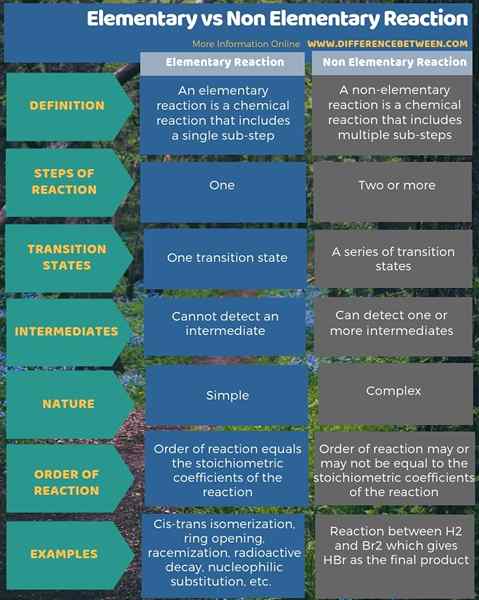
Ringkasan -reaksi dasar vs non -dasar
Singkatnya, reaksi dasar dan non-elemen dibagi berdasarkan jumlah sub-langkah reaksi kimia. Oleh karena itu, perbedaan utama antara reaksi dasar dan non-elemen adalah bahwa reaksi dasar memiliki satu langkah, sedangkan reaksi non-elemen memiliki beberapa langkah.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Reaksi Dasar."Thoughtco, dec. 6, 2018, tersedia di sini.
2. DDY, Prawin. “Reaksi Dasar dan Non Elementary (NO -18) - Salin."LinkedIn Slideshare, 29 Okt. 2015, tersedia di sini.
Gambar milik:
1. “Serangan Nukleofilik Ion Oksium” oleh Fhenatizs - Pekerjaan Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. “Kisi Titrasi Asam Oksalat” oleh MHz'as - ditransfer dari EN.Wikipedia (CC BY-SA 3.0) Via Commons Wikimedia


