Perbedaan antara konstanta kesetimbangan dan konstanta pembentukan
Itu perbedaan utama antara konstanta kesetimbangan dan konstanta pembentukan adalah itu Konstanta kesetimbangan adalah rasio antara konsentrasi produk dan konsentrasi reaktan pada keseimbangan sedangkan konstanta pembentukan adalah konstanta kesetimbangan untuk pembentukan senyawa koordinasi dari komponennya.
Konstanta kesetimbangan berguna dalam menjelaskan perilaku berbagai keadaan keseimbangan. Konstanta pembentukan adalah jenis konstanta kesetimbangan yang spesifik untuk pembentukan senyawa koordinasi; Misalnya, ion kompleks.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu keseimbangan konstan
3. Apa itu Formasi Konstan
4. Perbandingan berdampingan - konstanta konstanta kesetimbangan vs konstanta dalam bentuk tabel
5. Ringkasan
Apa itu keseimbangan konstan?
Konstanta kesetimbangan adalah rasio antara konsentrasi produk dan konsentrasi reaktan pada keseimbangan. Istilah ini hanya digunakan dengan reaksi yang berada dalam kesetimbangan. Kreasien reaksi dan konstanta kesetimbangan adalah sama untuk reaksi yang berada dalam keseimbangan.
Konstanta kesetimbangan juga diberikan sebagai konsentrasi yang diangkat ke kekuatan koefisien stoikiometrik. Konstanta kesetimbangan tergantung pada suhu sistem yang dipertimbangkan karena suhu mempengaruhi kelarutan komponen dan ekspansi volume. Namun, persamaan konstanta kesetimbangan tidak termasuk detail tentang padatan yang termasuk di antara reaktan atau produk. Hanya zat dalam fase cair dan fase gas yang dipertimbangkan.
Sebagai contoh, mari kita pertimbangkan keseimbangan antara asam karbonat dan ion bikarbonat.
H2BERSAMA3 (aq) ↔ hco3- (aq) + H+ (aq)
Konstanta kesetimbangan untuk reaksi di atas diberikan seperti di bawah ini.
Equilibrium Constant (k) = [HCO3- (aq)] [H+ (aq)] / [H2BERSAMA3 (aq)]

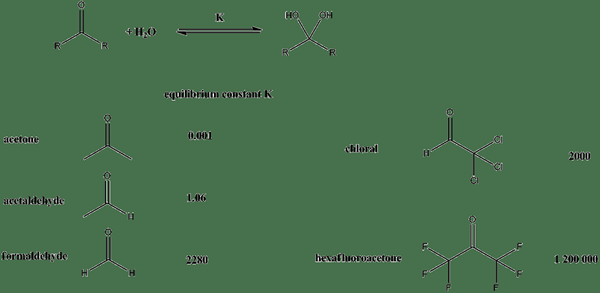
Gambar 01: Konstanta kesetimbangan untuk senyawa yang berbeda ketika mereka berada dalam larutan berair
Apa itu Formasi Konstan?
Konstanta pembentukan adalah konstanta kesetimbangan untuk pembentukan kompleks koordinat dari komponennya dalam suatu larutan. Kami dapat menunjukkannya sebagai KF. Keseimbangan ini terutama diterapkan untuk pembentukan ion kompleks. Komponen yang kita butuhkan untuk pembentukan ion kompleks adalah ion logam dan ligan.
Ion kompleks terbentuk sebagai hasil dari interaksi asam-basa Lewis dari ion logam dan ligan. Ion logam selalu membawa muatan positif dan bertindak sebagai asam Lewis sementara ligan harus membawa satu atau lebih pasangan elektron tunggal untuk bertindak sebagai basa Lewis. Ion logam kecil memiliki kecenderungan besar untuk membentuk ion yang kompleks karena mereka memiliki kepadatan muatan tinggi.
Secara umum, pembentukan ion kompleks adalah reaksi bertahap yang mencakup semua langkah yang terlibat dalam penambahan ligan satu per satu; Dengan demikian, langkah -langkah ini memiliki konstanta keseimbangan individu juga. Misalnya, pembentukan ion kompleks tembaga-amonium memiliki empat langkah. Oleh karena itu memiliki empat nilai konstan keseimbangan yang berbeda: K1, K2, K3 dan K4. Kemudian, konstanta pembentukan untuk reaksi keseluruhan adalah sebagai berikut:
KF = K1K2K3K4
Apa perbedaan antara konstanta keseimbangan dan konstanta pembentukan?
Konstanta kesetimbangan berguna dalam menjelaskan perilaku keadaan kesetimbangan yang berbeda, sedangkan konstanta pembentukan adalah jenis konstanta kesetimbangan. Perbedaan utama antara konstanta kesetimbangan dan konstanta pembentukan adalah bahwa konstanta kesetimbangan adalah rasio antara konsentrasi produk dan konsentrasi reaktan pada keseimbangan, sedangkan konstanta pembentukan adalah konstanta kesetimbangan untuk pembentukan senyawa koordinasi dari komponennya.
Di bawah infografis merangkum perbedaan antara konstanta kesetimbangan dan konstanta pembentukan.
Ringkasan -konstanta konstanta keseimbangan vs konstanta
Konstanta kesetimbangan berguna dalam menjelaskan perilaku keadaan kesetimbangan yang berbeda sementara konstanta pembentukan adalah jenis konstanta kesetimbangan. Perbedaan utama antara konstanta kesetimbangan dan konstanta pembentukan adalah bahwa konstanta kesetimbangan adalah rasio antara konsentrasi produk dan konsentrasi reaktan pada keseimbangan, sedangkan konstanta pembentukan adalah konstanta kesetimbangan untuk pembentukan senyawa koordinasi dari komponennya.
Referensi:
1. “17.3: Pembentukan ion kompleks.”Kimia Libretexts, Libretexts, 17 Juni 2019, tersedia di sini.
Gambar milik:
1. "Hydrationks" oleh Nikolaivica - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia


