Perbedaan antara titik kesetaraan dan titik akhir
Itu perbedaan utama antara titik kesetaraan dan titik akhir adalah bahwa Titik kesetaraan dalam titrasi adalah titik di mana titran yang ditambahkan secara kimiawi setara sepenuhnya dengan analit dalam sampel sedangkan titik akhir adalah titik di mana indikator mengubah warnanya.
Titrasi adalah teknik yang kami gunakan secara luas dalam kimia analitik untuk menentukan asam, basa, oksidan, reduktor, ion logam dan banyak spesies lainnya. Dalam titrasi, reaksi kimia terjadi. Di sini, seorang analit bereaksi dengan reagen standar, yang kami sebut sebagai titran. Terkadang kami menggunakan standar primer, yang merupakan solusi yang sangat murni dan stabil, sebagai bahan referensi dalam metode titrimetri. Kami menggunakan indikator untuk mendeteksi titik akhir reaksi. Tapi, ini bukan titik aktual di mana reaksi kimia berakhir. Titik sebenarnya adalah titik kesetaraan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa titik akhir
3. Apa titik kesetaraan
4. Perbandingan Berdampingan - Titik Kesetaraan vs Titik Akhir Dalam Bentuk Tabel
5. Ringkasan
Apa titik akhir?
Dalam titrasi apa pun, titik akhir adalah titik di mana indikator mengubah warnanya. Atau kita dapat menggunakan perubahan dalam respons instrumental untuk mengidentifikasi titik akhir. Misalnya, HCl dan NaOH bereaksi 1: 1 dan menghasilkan NaCl dan air. Untuk titrasi ini, kita dapat menggunakan indikator fenolftalein, yang memiliki warna merah muda dalam media dasar dan berubah menjadi tidak berwarna dalam medium asam. Jika kita menempatkan HCl di labu titrasi dan untuk itu, jika kita menambahkan setetes fenolftalein, itu menjadi tidak berwarna.

Gambar 02: Titik akhir adalah titik perubahan warna
Selama titrasi, kita dapat menambahkan NaOH dari burette dan secara bertahap, HCl dan NaOH akan bereaksi di labu. Jika kita mengambil konsentrasi yang sama dari dua solusi, ketika kita menambahkan jumlah NaOH yang sama ke labu, solusi dalam labu akan berubah menjadi warna merah muda muda. Inilah titik di mana kita menghentikan titrasi (titik akhir). Kami menganggap, pada titik ini, reaksinya selesai.
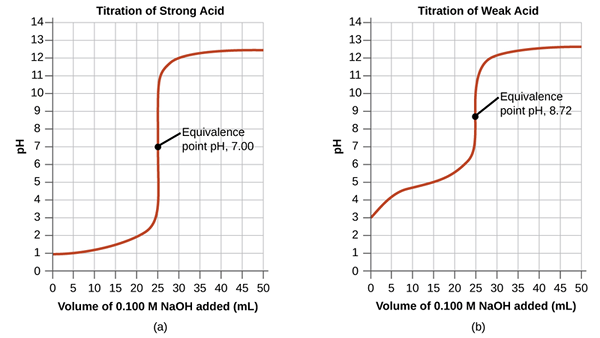
Apa titik kesetaraan?
Titik kesetaraan dalam titrasi adalah titik di mana titran yang ditambahkan secara kimia setara sepenuhnya dengan analit dalam sampel. Inilah titik di mana reaksi kimia selesai secara stoikiometri.

Gambar 01: Titik kesetaraan untuk asam kuat dan titrasi asam lemah
Meskipun kami menentukan titik akhir dari perubahan warna indikator, itu adalah, sebagian besar waktu, bukan titik akhir aktual dari reaksi. reaksi sedikit selesai sebelum titik itu. Pada titik kesetaraan ini, mediumnya netral. Dalam contoh yang dibahas di bagian sebelumnya, setelah menambahkan drop NaOH ekstra, media akan menunjukkan warna dasar fenolftalein, yang kami ambil sebagai titik akhir.
Apa perbedaan antara titik kesetaraan dan titik akhir?
Titik kesetaraan dalam titrasi adalah titik di mana titran yang ditambahkan secara kimiawi setara sepenuhnya dengan analit dalam sampel sedangkan titik akhir adalah titik di mana indikator mengubah warnanya. Ini adalah perbedaan utama antara titik kesetaraan dan titik akhir. Selain itu, titik kesetaraan selalu datang sebelum titik akhir titrasi.

Ringkasan - Titik Kesetaraan vs Titik Akhir
Dalam titrasi apa pun, kami memiliki dua poin penting; yaitu, titik setara dan titik akhir titrasi. Perbedaan utama antara titik kesetaraan dan titik akhir adalah bahwa titik kesetaraan dalam titrasi adalah titik di mana titran yang ditambahkan secara kimiawi setara sepenuhnya dengan analit dalam sampel sedangkan titik akhir adalah titik di mana indikator mengubah warnanya.
Referensi:
1. “Titik kesetaraan."Wikipedia, Wikimedia Foundation, 15 Apr. 2018. Tersedia disini
2. Libretexts. “Dasar -dasar titrasi.”Kimia Libretexts, Libretexts, 21 Juli 2016. Tersedia disini
Gambar milik:
1.”CNX Chem 14 07 Titration” oleh OpenStax (CC oleh 4.0) Via Commons Wikimedia
2.”Phenolphthalein in Flask” oleh 384 - karya sendiri, (CC BY -SA 4.0) Via Commons Wikimedia


