Perbedaan antara esterifikasi dan netralisasi
Itu perbedaan utama antara esterifikasi dan netralisasi adalah itu esterifikasi menghasilkan ester dari asam dan alkohol, sedangkan netralisasi menghasilkan garam dari asam dan basa.
Esterifikasi dan netralisasi adalah dua reaksi penting dari kimia. Esterifikasi, sesuai namanya, adalah reaksi kimia yang menghasilkan ester di akhir reaksi. Netralisasi mengacu pada keseimbangan keasaman dari alkalinitas.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu esterifikasi
3. Apa itu netralisasi
4. Perbandingan berdampingan - esterifikasi vs netralisasi dalam bentuk tabel
5. Ringkasan
Apa itu esterifikasi?
Esterifikasi adalah proses pembentukan ester dari asam dan alkohol. Asam biasanya merupakan asam karboksilat, dan alkohol harus menjadi alkohol primer atau sekunder. Dan, reaksinya terjadi di lingkungan asam. Dengan demikian, kami menggunakan asam sulfat sebagai asam yang kuat untuk reaksi. Itu bertindak sebagai katalis untuk reaksi karena campuran asam karboksilat dan alkohol tidak memberikan apa pun jika mediumnya tidak asam. Sebagai produk sampingan, molekul air terbentuk. Oleh karena itu, ini adalah reaksi kondensasi.
Ikatan PI dalam gugus karbonil asam karboksilat dapat bertindak sebagai basa karena distorsi elektron karena perbedaan elektronegativitas antara oksigen dan atom karbon. Elektron dalam ikatan PI diberikan pada satu atom hidrogen dalam molekul asam sulfat. Dengan demikian, ini mengubah ikatan -c = o menjadi -c -oh.
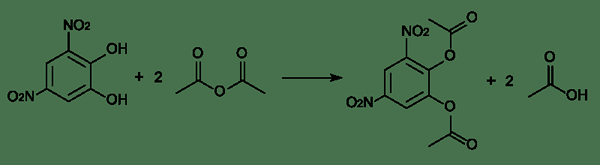
Gambar 01: Contoh reaksi esterifikasi
Di sini, atom karbon memiliki muatan positif karena hanya memiliki tiga ikatan kimia di sekitarnya. Kami menyebutnya karbokasi. Di hadapan alkohol, satu -satunya elektron berpasangan dalam atom oksigen alkohol dapat memberikan elektron pada atom karbon karbokasi. Oleh karena itu, alkohol bertindak sebagai nukleofil. Setelah itu, penataan ulang terjadi dan membentuk ester dan molekul air.
Apa itu netralisasi?
Netralisasi adalah jenis reaksi kimia di mana asam bereaksi dengan basa untuk membentuk garam dan air. Oleh karena itu, reaksi ini melibatkan kombinasi h+ ion dan oh- ion, dan menghasilkan air. Oleh karena itu, tidak ada ion hidrogen atau ion hidroksida dalam campuran reaksi setelah penyelesaian reaksi.

Jika asam yang kuat bereaksi dengan basa yang kuat, maka pH campuran reaksi akhir adalah 7. Selain itu, pH campuran reaksi tergantung pada kekuatan asam reaktan. Saat mempertimbangkan aplikasi netralisasi, penting dalam menentukan konsentrasi asam atau basa yang tidak diketahui, dalam proses pengolahan air limbah, dalam menetralkan asam lambung berlebih dengan tablet antasid, dll.
Apa kesamaan antara esterifikasi dan netralisasi?
- Kedua reaksi menghasilkan air sebagai produk sampingan
- Kedua reaksi melibatkan kombinasi h+ ion dan oh-
Apa perbedaan antara esterifikasi dan netralisasi?
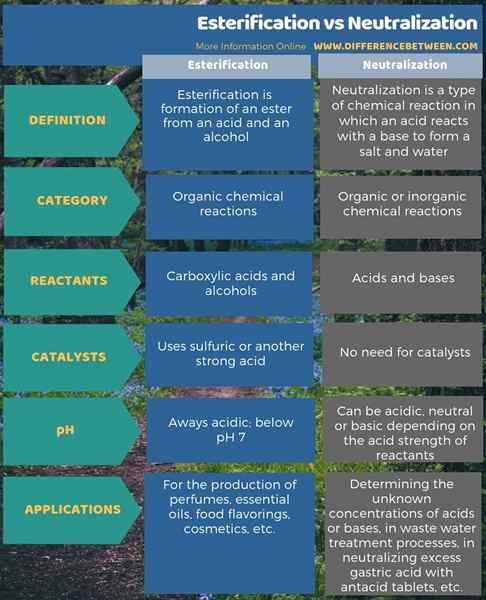
Esterifikasi dan netralisasi adalah reaksi penting dalam kimia. Perbedaan utama antara esterifikasi dan netralisasi adalah bahwa esterifikasi menghasilkan ester dari asam dan alkohol, sedangkan netralisasi menghasilkan garam dari asam dan basa. Selain itu, reaktan untuk esterifikasi adalah asam karboksilat dan alkohol sedangkan untuk netralisasi, reaktan adalah asam dan basa.
Selain itu, perbedaan lain antara esterifikasi dan netralisasi adalah bahwa esterifikasi membutuhkan katalis seperti asam sulfat sementara netralisasi tidak memerlukan katalis pun.
Ringkasan -esterifikasi vs netralisasi
Esterifikasi dan netralisasi adalah reaksi penting dalam kimia. Singkatnya, perbedaan utama antara esterifikasi dan netralisasi adalah bahwa esterifikasi menghasilkan ester dari asam dan alkohol, sedangkan netralisasi menghasilkan garam dari asam dan basa.
Referensi:
1. “Mekanisme esterifikasi (kimia organik) - Chemistryscore.“Pelajari kimia di sini, 19 September. 2018, tersedia di sini.
2. Admin. “Ester - Proses esterifikasi dengan struktur, sifat & penggunaan.”Byjus, Byju's, 25 Juli 2018, tersedia di sini.
Gambar milik:
1. “Esterifikasi 3,5-Dinitrocatechol” oleh Megabyte07-Karya Sendiri (CC BY-SA 3.0) Via Commons Wikimedia
2. "Titolazione" oleh Luigi Chiesa - Draw oleh Luigi Chiesa (domain publik) melalui Commons Wikimedia


