Perbedaan antara reaksi urutan pertama dan kedua
Itu perbedaan utama Antara reaksi urutan pertama dan kedua adalah itu Tingkat reaksi urutan pertama tergantung pada kekuatan pertama konsentrasi reaktan dalam persamaan laju sedangkan laju reaksi urutan kedua tergantung pada daya kedua istilah konsentrasi dalam persamaan laju.
Urutan reaksi adalah jumlah kekuatan yang menjadi konsentrasi reaktan dalam persamaan hukum tingkat. Ada beberapa bentuk reaksi sesuai dengan definisi ini; Nol reaksi urutan (reaksi ini tidak tergantung pada konsentrasi reaktan), reaksi urutan pertama dan reaksi urutan kedua.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa reaksi pesanan pertama
3. Apa reaksi urutan kedua
4. Perbandingan berdampingan - reaksi urutan kedua vs kedua dalam bentuk tabel
5. Ringkasan
Apa reaksi pesanan pertama?
Reaksi urutan pertama adalah reaksi kimia di mana laju reaksi tergantung pada konsentrasi molar salah satu reaktan yang terlibat dalam reaksi. Oleh karena itu, sesuai dengan definisi di atas untuk urutan reaksi, jumlah kekuatan yang menjadi konsentrasi reaktan dalam persamaan hukum tingkat akan selalu menjadi 1. Mungkin ada reaktan tunggal yang mengambil bagian dalam reaksi ini. Kemudian konsentrasi reaktan menentukan laju reaksi. Tetapi kadang -kadang, ada lebih dari satu reaktan yang mengambil bagian dalam reaksi ini, maka salah satu reaktan ini akan menentukan laju reaksi.
Mari kita pertimbangkan contoh untuk memahami konsep ini. Dalam reaksi dekomposisi n2HAI5, itu membentuk no2 dan o2 gas sebagai produk. Karena hanya memiliki satu reaktan, kita dapat menulis reaksi dan persamaan laju sebagai berikut.
2n2HAI5 (g) → 4no2 (g) + HAI2 (g)
Tarif = k [n2HAI5 (g)]M
Di sini k adalah konstanta laju untuk reaksi ini dan m adalah urutan reaksi. Oleh karena itu, dari penentuan eksperimental, nilai m adalah 1. Jadi, ini adalah reaksi urutan pertama.
Apa reaksi urutan kedua?
Reaksi urutan kedua adalah reaksi kimia di mana laju reaksi tergantung pada konsentrasi molar dua reaktan atau kekuatan kedua dari satu reaktan yang terlibat dalam reaksi. Oleh karena itu, sesuai dengan definisi di atas untuk urutan reaksi, jumlah kekuatan yang menjadi konsentrasi reaktan dalam persamaan hukum laju akan selalu 2. Jika ada dua reaktan, laju reaksi akan tergantung pada kekuatan pertama konsentrasi masing -masing reaktan.

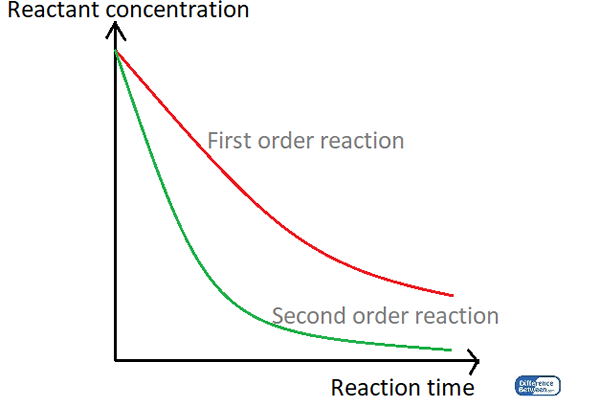
Gambar 01: Grafik yang membandingkan dua jenis urutan reaksi menggunakan waktu reaksi mereka dan konsentrasi reaktan.
Jika kita meningkatkan konsentrasi reaktan sebesar 2 kali (jika ada dua reaktan dalam persamaan laju), maka laju reaksi meningkat 4 kali. Misalnya, mari kita pertimbangkan reaksi berikut.
2a → p
Di sini A adalah reaktan dan p adalah produknya. Maka jika ini adalah reaksi urutan kedua, persamaan laju untuk reaksi ini adalah sebagai berikut.
Tingkat = k [a]2
Tetapi untuk reaksi dengan dua reaktan berbeda seperti berikut;
A +b → p
Tingkat = k [a]1[B]1
Apa perbedaan antara reaksi urutan pertama dan kedua?
Reaksi urutan pertama adalah reaksi kimia di mana laju reaksi tergantung pada konsentrasi molar salah satu reaktan yang terlibat dalam reaksi. Oleh karena itu, jika kita meningkatkan konsentrasi reaktan 2 kali, laju reaksi meningkat 2 kali. Reaksi urutan kedua adalah reaksi kimia di mana laju reaksi tergantung pada konsentrasi molar dua reaktan atau kekuatan kedua dari satu reaktan yang terlibat dalam reaksi. Oleh karena itu, jika kita meningkatkan konsentrasi reaktan 2 kali, laju reaksi meningkat 4 kali. Infografis di bawah ini menyajikan perbedaan antara reaksi urutan pertama dan kedua dalam bentuk tabel.

Ringkasan -Reaksi urutan kedua vs kedua
Ada tiga jenis reaksi utama sesuai dengan urutan reaksi; Nol Urutan, Urutan Pertama dan Reaksi Urutan Kedua. Perbedaan utama antara reaksi urutan pertama dan kedua adalah bahwa laju reaksi urutan pertama tergantung pada kekuatan pertama konsentrasi reaktan dalam persamaan laju sedangkan laju reaksi urutan kedua tergantung pada daya kedua dari istilah konsentrasi dalam Nilai Persamaan.
Referensi:
1. Libretexts. “Metode menentukan urutan reaksi.”Kimia Libretexts, Libretexts, 5 Juni 2017. Tersedia disini


